ņä£ ļĪĀ
Moscona & Moscona(advances in multicellular spheroids formation-5)ņŚÉ ņØśĒĢ┤ ņ▓śņØī ņåīĻ░£ļÉ£ 3ņ░©ņøÉ ņןĻĖ░ņ£Āņé¼ņ▓┤ļŖö ņäĖĒżĻ░ä ĻĘĖļ”¼Ļ│Ā ņäĖĒżņÖĆ ĻĖ░ņ¦łĻ░äņØś ņāüĒśĖņ×æņÜ®ņØä ļÅÖļ░śĒĢ£ ņäĖĒżņØś ņ¦æĒĢ®ņ▓┤ļĪ£ ņāØņ▓┤ņØś ĻĄ¼ņĪ░ņÖĆ ĻĖ░ļŖźņØä ļ¬©ņé¼ĒĢśņŚ¼ ņāØņ▓┤ ļé┤(in-vivo)ņŗżĒŚśĻ│╝ ņ£Āņé¼ĒĢ£ ĒÖśĻ▓ĮņØä ĻĄ¼ĒśäĒĢ©ņ£╝ļĪ£ņŹ© ņØ┤ļ»Ė ļŗżņ¢æĒĢ£ ĻĖ░ņ┤ł ņāØļ¼╝ĒĢÖĻ│╝ ņ×äņāü ņĀüņÜ®ņØä ļ¬®Ēæ£ļĪ£ ĒĢśļŖö ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼ņŚÉ ĒÖ£ņÜ®ļÉśĻ│Ā ņ׳ļŗż. Ļ│╝Ļ▒░, ņśżĻ░ĆļģĖņØ┤ļō£ļ×Ć ļŗ©ņ¢┤ļŖö 1ņ░© ņĪ░ņ¦ü(primary tissue) ļśÉļŖö ĻĘĖļ│┤ļŗż ĒĢśņ£ä 1ņ░© ņäĖĒż(primary cell), ļ░░ņĢä ņżäĻĖ░ņäĖĒż(embryonic stem cell) ļ░Å ņ£ĀļÅäļ¦īļŖźņżäĻĖ░ņäĖĒż(induced pluripotent stem cell), ņäĖĒżņŻ╝(cell line), ĻĘĖļ”¼Ļ│Ā ņŚ¼ļ¤¼ ņĪ░ņ¦ü ņ£ĀĒśĢļōżļĪ£ ĻĄ¼ņä▒ļÉ£ ņןĻĖ░ ņÖĖņŗØĒÄĖ(explant)Ļ│╝ Ļ░ÖņØĆ ņĀäņ▓┤ ļśÉļŖö ļČäņĀłļÉ£ ĻĖ░Ļ┤ĆņŚÉņä£ ļ╣äļĪ»ļÉ£ ļ¬©ļōĀ 3ņ░©ņøÉ ĻĖ░Ļ┤ĆĒśĢ ļ░░ņ¢æņ▓┤(organotypic culture)ļź╝ ĒżĒĢ©ĒĢśņŚ¼ ņØ╝ņ╗½ļŖö ņÜ®ņ¢┤ņśĆļŗż. ĻĘĖļ¤¼ļéś, ņĄ£ĻĘ╝ ļ¦ÄņØĆ ļ¼ĖĒŚīļōżņŚÉņä£ļŖö ņןĻĖ░ļ¬©ņé¼ņ▓┤ļź╝ ņżäĻĖ░ņäĖĒżļĪ£ļČĆĒä░ ļČäĒÖöĒĢśņŚ¼ ņ▓┤ņÖĖ(in-vitro)ņŚÉņä£ ļŗżņäĖĒż ņØĖņ▓┤ņ£Āņé¼ņĪ░ņ¦üņ£╝ļĪ£ ļČäĒÖöņŗ£ņ╝£ ņāØņé░ĒĢśļŖö ņśżĻ░ĆļģĖņØ┤ļō£(Organoid)ņÖĆ ņØ┤ļ»Ė ļČäĒÖöļÉ£ ņØĖņ▓┤ņןĻĖ░ņØś ņäĖĒżļź╝ ļČäļ”¼ĒĢśņŚ¼ ņ▓┤ņÖĖ(in-vitro)ņŚÉņä£ 3ņ░©ņøÉ ļ░░ņ¢æņŚÉ ņØśĒĢ┤ ĻĄ¼ļ¬©ņ¢æņ£╝ļĪ£ ļ¦īļōżņ¢┤ņ¦ĆļŖö ņŖżĒÄśļĪ£ņØ┤ļō£(spheroid)ļĪ£ Ēü¼Ļ▓ī ĻĄ¼ļČäĒĢśņŚ¼ ļČĆļź┤ĻĖ░ļÅä ĒĢ£ļŗż[1].
ņśżĻ░ĆļģĖņØ┤ļō£ ļśÉļŖö ņŖżĒÄśļĪ£ņØ┤ļō£ņÖĆ Ļ░ÖņØĆ 3ņ░©ņøÉ ļ░░ņ¢æĻĖ░ļ▓ĢņØ┤ 2ņ░©ņøÉ ļŗ©ņĖĄļ░░ņ¢æņŚÉ ļ╣äĒĢ┤ ņāØļ”¼ĒĢÖņĀüņ£╝ļĪ£ ņŗżņĀ£ ņāØņ▓┤ ļé┤ ĒÖśĻ▓ĮĻ│╝ ļ¦żņÜ░ ņ£Āņé¼ĒĢśĻ│Ā, ņāØņĪ┤ļŖźļĀź(viability)Ļ│╝ ĻĖ░ļŖźņä▒ņØ┤ Ē¢źņāüļÉśļ®░ ņāØņ▓┤ ļé┤ ļ¬©ļŹĖļ│┤ļŗż ņŻ╝ļ│Ćļ»ĖņäĖĒÖśĻ▓Į ĻĄ¼ņä▒ņÜöņåī(niche component), ņŗĀĒśĖ ņĀäļŗ¼ Ļ▓ĮļĪ£ ļ░Å ņ£ĀņĀäņ▓┤ ņĪ░ņ×æņØä ĒåĄĒĢ£ ĻĖ░ļŖźĒ¢źņāüņØ┤ Ēø©ņö¼ ļŹö Ļ░äĒÄĖĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņĀäĒåĄņĀüņØĖ 2ņ░©ņøÉ ļŗ©ņĖĄļ░░ņ¢æĻ│╝ ņāØņ▓┤ ļé┤ ļÅÖļ¼╝/ņØĖĻ░ä ļ¬©ļŹĖņé¼ņØ┤ņØś ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ ņłś ņ׳ļŗż[2].
ļ│Ė ļ¼ĖĒŚīņŚÉņä£ļŖö ņĄ£ĻĘ╝ ļŗżņ¢æĒĢ£ ĻĖ░ņ┤łņŚ░ĻĄ¼ ļČäņĢ╝ ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņ×äņāüņĀüņØĖ ņĀüņÜ®Ļ╣īņ¦Ć ņŗ£ļÅäļÉśĻ│Ā ņ׳ļŖö ņĄ£ņŗĀ 3ņ░©ņøÉ ņäĖĒżļ░░ņ¢æĻĖ░ļ▓ĢļōżņØä ļČäĒÖöļÉ£ 1ņ░© ņäĖĒżļź╝ ņØ┤ņÜ®ĒĢ£ ņŖżĒÄśļĪ£ņØ┤ļō£ ņĀ£ņ×æļ▓ĢņŚÉ ņżæņĀÉņØä ļæÉņ¢┤ ņäżļ¬ģĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ļ│Ė ļĪĀ
ņŖżĒÄśļĪ£ņØ┤ļō£ ĒśĢņä▒Ļ│╝ņĀĢ
ņŖżĒÄśļĪ£ņØ┤ļō£ļź╝ ĒśĢņä▒ĒĢśĻĖ░ ņ£äĒĢ£ ņäĖĒżĻ░ä ņ£Āņ░® ļ░Å ļČäĒÖöļŖö 1) ņØĖĒģīĻĘĖļ”░(integrin)Ļ│╝ ņäĖĒżņÖĖĻĖ░ņ¦ł(extracellular matrix)ņØś Ļ▓░ĒĢ®ņŚÉ ņØśĒĢ£ ļČłņÖäņĀäĒĢ£ ņäĖĒżņØæņ¦æ(cell aggregation), 2) ņ║Éļō£ĒŚżļ”░(cadherin)ņØś ļ░£ĒśäĻ│╝ ņČĢņĀü, 3) ņ║Éļō£ĒŚżļ”░ Ļ░ä(cadherin to cadherin)ņØś ļÅÖņóģņ╣£ĒÖöņä▒ ņāüĒśĖņ×æņÜ®(homophilic interaction)ņŚÉ ņØśĒĢ£ ĻĄ¼ņ▓┤(spheroid)ņĪ░ņ¦ü ĒśĢņä▒ņØś 3ļŗ©Ļ│äļĪ£ ĻĄ¼ļČäļÉ£ļŗż(Fig. 1)[3].
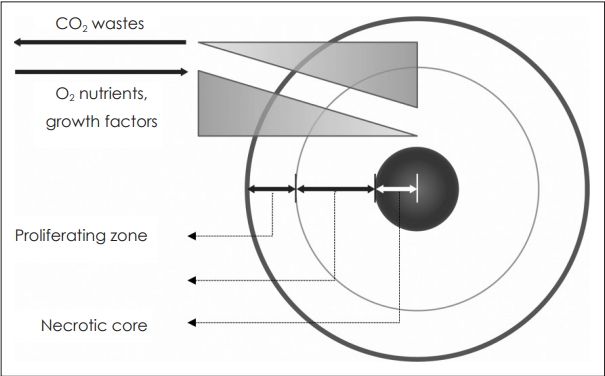
ņŖżĒÄśļĪ£ņØ┤ļō£ļŖö ņāØņä▒ņ┤łĻĖ░ņŚÉļŖö ĒśłĻ┤Ćņä▒ņØ┤ ņŚåļŖö ņĪ░ņ¦ü(avascular tissue)ņ£╝ļĪ£ 150~200 ╬╝m ņØ┤ļé┤ņØś ņĀ£ĒĢ£ļÉ£ ļ▓öņ£ä ļé┤ņŚÉņä£ ĒÖĢņé░(diffusion)ņŚÉ ņØśĒĢ┤ ĒĢäņÜöĒĢ£ ļ¼╝ņ¦łĻ│╝ ņé░ņåīļź╝ ņÖĖļČĆļĪ£ļČĆĒä░ Ļ│ĄĻĖēļ░øĻ▓ī ļÉśļ®░ ļé┤ļČĆņØś ļīĆņé¼ļģĖĒÅÉļ¼╝ņØä ļ░░ņČ£ĒĢ£ļŗż.
ļö░ļØ╝ņä£, ņ¦üĻ▓Į 500 ╬╝mļź╝ ņ┤łĻ│╝ĒĢśļŖö ņŖżĒÄśļĪ£ņØ┤ļō£ļŖö ĒØöĒ׳ ļé┤ļČĆņØś Ļ┤┤ņé¼ņĪ░ņ¦ü(necrotic core)Ļ│╝ ņÖĖļČĆņØś ņāØņĪ┤ņĪ░ņ¦ü(viable rim)ņØ┤ ļØĀ ļ¬©ņ¢æņ£╝ļĪ£ ņĖĄĻĄ¼ņĪ░ļź╝ ĒśĢņä▒ĒĢśĻ│Ā ņ׳ņ£╝ļ®░ ņāØņĪ┤ņĪ░ņ¦üņØĆ ļŗżņŗ£ ļé┤ļČĆņØś Ē£┤ņ¦ĆĻĖ░ņäĖĒż ĻĄ¼ņŚŁ(quiescent viable cell zone)Ļ│╝ ņ”ØņŗØņäĖĒżĻĄ¼ņŚŁ(proliferating zone)ņ£╝ļĪ£ ļéśļē£ļŗż(Fig. 2).
ņØ┤ļĀćĻ▓ī ņāØņä▒ļÉ£ ņŖżĒÄśļĪ£ņØ┤ļō£ļŖö 2ņ░©ņøÉ ļŗ©ņĖĄļ░░ņ¢æļÉ£ ņĪ░ņ¦üĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ļŹö ņāØņĪ┤ļĀźņØ┤ ļåÆĻ│Ā ļŗżņ¢æĒĢ£ ņ£ĀņĀäņ×ÉĻ░Ć ļ░£ĒśäļÉśļ®░ ņØ┤ ņ£ĀņĀäņ×ÉļōżņØĆ ļ¬©ņé¼ĒĢśĻ│Āņ×É ĒĢśļŖö ņāØņ▓┤ ņĪ░ņ¦üņŚÉ Ļ│Āņ£ĀĒĢ£ ņ£ĀņĀäņ×É ņĀäņé¼ņØĖņ×Éļź╝ ĒżĒĢ©ĒĢśĻ│Ā ņ׳ņ¢┤ ņŗżņĀ£ ņāØņ▓┤ ņĪ░ņ¦üĻ│╝ ļŹö ņ£Āņé¼ĒĢ£ ĻĖ░ļŖźņØä Ļ░¢Ļ▓ī ļÉ£ļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[4].
ĒŖ╣Ē׳, ņØ┤ļ¤¼ĒĢ£ Ļ│Āņ£ĀĒĢ£ ņĪ░ņ¦ü ĒŖ╣ņä▒ņØä ĒÜ©Ļ│╝ņĀüņØ┤Ļ│Ā ņĢłņĀĢņĀüņ£╝ļĪ£ ļ░£ĒśäĒĢśļŖö ņןņĀÉņØĆ ņóģņ¢æ ņŚ░ĻĄ¼ņŚÉ ņ׳ņ¢┤ ļ¦żņÜ░ Ļ░Ćņ╣ś ņ׳ļŖö ņĀÉņØ┤ļØ╝ ĒĢĀ ņłś ņ׳Ļ▓Āļŗż[5].
ņ¦ĆĻĖłĻ╣īņ¦Ć ļ│┤Ļ│ĀļÉ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ ļ│╝ ņłś ņ׳ļō»ņØ┤ ņŖżĒÄśļĪ£ņØ┤ļō£ļŖö ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼ļČäņĢ╝ņŚÉ ņĀüņÜ®ļÉśĻ│Ā ņ׳ņ£╝ļ®░ ļīĆĒæ£ņĀüņØĖ ņśłļĪ£ļŖö ņóģņ¢æņØś ņ╣śļŻī ĒÜ©ņÜ®ņä▒ ĒÅēĻ░Ć, ņ£ĀņĀäņ×É ĻĖ░ļŖź ļČäņäØņØä ņØ┤ņÜ®ĒĢ£ ļ░£ņĢöņä▒ ĻĖ░ņĀä ņŚ░ĻĄ¼ ļ░Å ņäĖĒż Ļ┤┤ņé¼-ĒśĢņä▒ Ļ│╝ņĀĢņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼, ĒśłĻ┤Ć ņĪ░ņ¦ü ņāØņä▒ņŚÉ ņ׳ņ¢┤ ņäĖĒż Ļ░ä ņāüĒśĖņ×æņÜ®Ļ│╝ ņä£ļĪ£ ļŗżļźĖ ņĪ░ņ¦üņ£╝ļĪ£ņØś ļČäĒÖö Ļ│╝ņĀĢņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ņÖĆ ņןĻĖ░ Ēöäļ”░Ēīģ(organ printing)Ļ│╝ Ļ░ÖņØĆ ņןĻĖ░ ņ×¼ņāØņØś ņĪ░ņ¦üĻ│ĄĒĢÖņĀü ņŗ£ļÅäņŚÉ ņĀüņÜ®ļÉśĻ│Ā ņ׳ļŗż[6-11].
ņŖżĒÄśļĪ£ņØ┤ļō£ ņĀ£ņ×æĻĖ░ļ▓Ģļōż
ņŖżĒÄśļĪ£ņØ┤ļō£ļź╝ ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼ņŚÉ ļŗ©ņł£ĒĢśĻ│Ā ņ×¼Ēśäņä▒ņØ┤ ņóŗņØĆ ņŖżĒÄśļĪ£ņØ┤ļō£ ņĀ£ņ×æ ļ░®ļ▓ĢņØĆ ĒĢäņłśņĀüņØ┤ļØ╝ ĒĢĀ ņłś ņ׳ļŗż. ņŖżĒÄśļĪ£ņØ┤ļō£ ņĀ£ņ×æņŚÉ ņ׳ņ¢┤ Ļ░Ćņן ĻĖ░ļ│ĖņĀüņØĖ ņÜöņåīļŖö ņäĖĒżļōżņØ┤ ļ░░ņ¢æ ņĀæņŗ£ņŚÉ ņ£Āņ░®ļÉśņ¦Ć ņĢŖĻ│Ā ļ░░ņ¢æļÉśļŖö Ļ▓āņØ┤ļ®░ ļŗżņ¢æĒĢ£ ņĀ£ņ×æļ▓Ģļōż ņżæ ņŚ░ĻĄ¼ ļ¬®ņĀüņŚÉ ļ¦×ļŖö ļ░®ļ▓ĢņØä ņäĀĒāØĒĢ©ņŚÉ ņ׳ņ¢┤ ņŖżĒÄśļĪ£ņØ┤ļō£ ņĀ£ņ×æņØś ĒÜ©ņ£©ņä▒, ņĀ£ņ×æļÉ£ ņŖżĒÄśļĪ£ņØ┤ļō£ Ēü¼ĻĖ░ņØś ĻĘĀņØ╝ņä▒, ņĀ£ņ×æĻ│╝ņĀĢņŚÉņä£ ļ░£ņāØ Ļ░ĆļŖźĒĢ£ ņäĖĒż Ļ│Āņ£ĀĻĖ░ļŖźņØś ņśüĒ¢ź, ņĀ£ņ×æ ĒÄĖņØ┤ņä▒Ļ│╝ ņŚ░ĻĄ¼ ņĀüĒĢ®ņä▒ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņäĀĒāØĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. ĒøäņłĀĒĢĀ Ļ░ü ņĀ£ņ×æĻĖ░ļ▓ĢļōżņØĆ Fig. 3Ļ│╝ Table 1ņŚÉ Ļ░üĻ░üņØś ņøÉļ”¼ņÖĆ ņןļŗ©ņĀÉņØä ņĀĢļ”¼ĒĢśņśĆļŗż.
ĒśäņĀüļ░░ņ¢æ(haning-drop cultures)
ĒśäņĀüļ░░ņ¢æ(haning-drop cultures)ņØĆ ņäĖĒżņĢĪ ļ░®ņÜĖņØ┤ ļ░░ņ¢æ ņĀæņŗ£ ņ£äņŚÉ ņ£äņ╣śĒĢ£ ļ░░ņ¢æĒīÉņŚÉ ļ¦żļŗ¼ļ”░ ņ▒äļĪ£ ļ░®ņÜĖ ļé┤ļČĆņØś ņäĖĒżļōżņØ┤ ņżæļĀźņŚÉ ņØśĒĢ┤ ņĢäļלņŚÉ ņØæņ¦æĒĢśņŚ¼ ņĪ░ņ¦üņØä ĒśĢņä▒ĒĢśĻ▓ī ļÉśļŖö ņøÉļ”¼ņØ┤ļŗż(Figs. 3A and 4). Ļ░ü ņäĖĒż ļ░®ņÜĖņØś ņÜ®ļ¤ēņØĆ 15~30 ╬╝L Ēü¼ĻĖ░ņØ┤ļ®░ Ļ░ü ņäĖĒżņĢĪ ļ░®ņÜĖ ļŗ╣ ļīĆļץ 300~3000Ļ░£ņØś ņäĖĒżļź╝ ļé┤ļČĆņŚÉ ĒżĒĢ©ĒĢĀ ņłś ņ׳ļŗż[3,12]. 4~7ņØ╝ Ēøä ņŖżĒÄśļĪ£ņØ┤ļō£ ņĪ░ņ¦üņØ┤ ņÖäņä▒ļÉśļ®┤ ņäĖĒżļ░®ņÜĖņØ┤ ņĢäļלņ¬ĮņŚÉ ļ¦żļŗ¼ļ”░ ļ¬©ļלņŗ£Ļ│ä ļ¬©ņ¢æņØś ļ¦łņØ┤Ēü¼ļĪ£ņ▒äļäÉ(microchannel)ņØś ņ£äņ¬Į ņ×ģĻĄ¼ņŚÉ ņäĖĒżņĢĪņØä ņŻ╝ņ×ģĒĢśļŖö ļ░®ņŗØņ£╝ļĪ£ ņÖäņä▒ļÉ£ ņŖżĒÄśļĪ£ņØ┤ļō£ļź╝ ņĢäļלļĪ£ ļ░Ćņ¢┤ļé┤ ļé┤ļČĆņŚÉ ņ£Āņ░®ļ░®ņ¦Ćņ▓śļ”¼ ļÉ£ ļ░░ņ¢æņÜ®ĻĖ░ņŚÉ ļŗ┤ņĢä ļ░░ņ¢æĒĢśĻ▓ī ļÉ£ļŗż. ņØ┤ ĻĖ░ļ▓ĢņØĆ ņŖżĒÄśļĪ£ņØ┤ļō£ņØś Ēü¼ĻĖ░, ļé┤ļČĆņØś ņäĖĒżņłśņÖĆ ņäĖĒżĻĄ¼ņä▒ņØä ĻĘĀņØ╝ĒĢśĻ▓ī ņĪ░ņĀłĒĢśņŚ¼ ņĀ£ņ×æĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ņ¢┤ ņŖżĒÄśļĪ£ņØ┤ļō£ ņĀ£ņ×æ ņżæ ļ░£ņāØĒĢĀ ņłś ņ׳ļŖö ņäĖĒż ļ░Å ļČäņ×Éļŗ©ņ£äņØś ĒśäņāüņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼, ņóģņ¢æņØś ņ╣©ņŖĄņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼, ņØ┤ņóģņØś ņäĖĒżĻ░ä ņāüĒśĖņ×æņÜ® ļ░Å ņĪ░ņ¦üņØś ĒśłĻ┤ĆĒÖö Ļ│╝ņĀĢņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ņŚÉ ņĀüņÜ®ļÉśĻ│Ā ņ׳ļŗż[13-15].
Ēæ£ļ®┤ņ£Āņ░®ļ░®ņ¦Ćņ▓śļ”¼ ļ¦łņØ┤Ēü¼ļĪ£ ņø░ ĒöīļĀłņØ┤ĒŖĖ(microwell plates with non-adhesive surface)
Ļ░Ćņן ļŗ©ņł£ĒĢśļ®┤ņä£ ņÜ®ņØ┤ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ ņäĖĒżĻ░Ć Ēæ£ļ®┤ņŚÉ ņ£Āņ░®ļÉśņ¦Ć ņĢŖĻ▓ī ļé┤ļČĆņ▓śļ”¼ ļÉ£ ĒĢśļŗ©ņØ┤ ļæźĻĘ╝ ļ¦łņØ┤Ēü¼ļĪ£ ņø░ ĒöīļĀłņØ┤ĒŖĖ(microwell plate with non-adhesive surface) ļé┤ņŚÉ ņäĖĒżļź╝ ĒĢ©ņ£ĀĒĢ£ ļ░░ņ¢æņĢĪņØä ļŗ┤ņĢä ņżæļĀźņŚÉ ņØśĒĢ┤ ņäĖĒżļōżņØ┤ ņĢäļלļĪ£ ļ¬©ņØ┤ļ®┤ņä£ ļæźĻĘ╝ ņĪ░ņ¦üņØä ĒśĢņä▒ĒĢśĻ▓ī ļÉśļŖö ņøÉļ”¼ļĪ£ ņ┤łņŗ¼ņ×ÉļōżļÅä ņēĮĻ▓ī ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŖö ņÜ®ņØ┤ĒĢ£ ļ░®ļ▓ĢņØ┤ļ®┤ņä£ ĻĘĀņØ╝ĒĢ£ Ēü¼ĻĖ░ņÖĆ ņäĖĒżņĪ░ņä▒ņØä ņĪ░ņĀłĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ļŗż(Fig. 3B). ļŗżļ¦ī, ĒśäņĀüļ░░ņ¢æņŚÉ ļ╣äĒĢ┤ Ēü¼ĻĖ░ņØś ĻĘĀņØ╝ņä▒ņØ┤ ļŗżņåī ļ¢©ņ¢┤ņ¦ł ņłś ņ׳ņ£╝ļéś ļŗżļźĖ ļ░®ļ▓ĢļōżņŚÉ ļ╣äĒĢ┤ ļ╣äĻĄÉņĀü ĻĘĀņØ╝ĒĢ£ Ēü¼ĻĖ░ņØś ņŖżĒÄśļĪ£ņØ┤ļō£ļź╝ ļ¦īļōż ņłś ņ׳Ļ│Ā, ļ░®ļ▓Ģ ļśÉĒĢ£ ĒśäņĀüļ░░ņ¢æņŚÉ ļ╣äĒĢ┤ ņÜ®ņØ┤ĒĢśņŚ¼ Ļ░Ćņן ĒØöĒĢśĻ▓ī ņØ┤ņÜ®ļÉśļŖö ļ░®ļ▓ĢņØ┤ļØ╝Ļ│Ā ļ│╝ ņłśņ׳ļŗż. ņØ┤ ļ░®ļ▓ĢņØś Ļ▓ĮņÜ░ ĒśäņĀüļ░░ņ¢æĻ│╝ Ļ░ÖņØ┤ ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼ļČäņĢ╝ņŚÉ ņĀüņÜ®ļÉśĻ│Ā ņ׳ņ£╝ļ®░ ņŖżĒÄśļĪ£ņØ┤ļō£ņØśļź╝ ņäĖĒżņĢĪ ļé┤ņØś ņäĖĒżļåŹļÅä ļ░Å ļ¦łņØ┤Ēü¼ļĪ£ ņø░ņØś Ēü¼ĻĖ░ļź╝ ņĪ░ņĀłĒĢ©ņ£╝ļĪ£ņŹ© ļŗżņ¢æĒĢ£ Ēü¼ĻĖ░ļĪ£ ņĀ£ņ×æĻ░ĆļŖźĒĢśļŗż[16,17].
ļ»ĖņäĖņĀ£ņ×æĻĄ¼ņĪ░ĒŗĆ(microfabricated microstructures)ņØä ņØ┤ņÜ®ĒĢ£ ļ░░ņ¢æ
ņØ┤ ļ░®ļ▓ĢņØĆ ņĀäņłĀĒĢ£ ļ¦łņØ┤Ēü¼ļĪ£ ņø░ ĒöīļĀłņØ┤ĒŖĖļź╝ ņØ┤ņÜ®ĒĢ£ ļ░░ņ¢æĻ│╝ ĻĘĖ ņøÉļ”¼ļŖö Ļ░Öņ£╝ļéś ņĢäĻ░ĆļĪ£ņ”ł(agarose) ļśÉļŖö ĒÅ┤ļ”¼ņŚÉĒŗĖļĀī ĻĖĆļ”¼ņĮ£(Polyethylene glycol)Ļ│╝ Ļ░ÖņØĆ ļČłĒÖ£ņä▒ļ¼╝ņ¦łņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņäĖĒżņĢĪņØä ļŗ┤ļŖö ļ¦łņØ┤Ēü¼ļĪ£ ņø░ņØä ņĀ£ņ×æņØśļÅäņŚÉ ļ¦×Ļ▓ī ņäżĻ│äĒĢśļŖö ļ¦łņØ┤Ēü¼ļĪ£ļ¬░ļö®(micromolding) ĻĖ░ļ▓ĢņØä ņé¼ņÜ®ĒĢ£ļŗż(Fig. 3C). ņŖżĒÄśļĪ£ņØ┤ļō£ņØś Ēü¼ĻĖ░, ņäĖĒżņĪ░ņä▒ ļ░Å ļé┤ļČĆĻĄ¼ņĪ░ļź╝ ļŗżņ¢æĒĢ£ ĒśĢĒā£ļĪ£ ļ»ĖņäĖĒĢśĻ▓īņĪ░ņĀłĒĢĀ ņłś ņ׳ļŖö ņĀÉņØ┤ ņןņĀÉņØ┤ļŗż[18-23].
ĒÜīņĀä ļ░öņØ┤ņśżļ”¼ņĢĪĒä░
ļé┤ļČĆņŚÉ ņ£Āņ░®ļ░®ņ¦Ćņ▓śļ”¼ ļÉ£ ĒÜīņĀä ĒöīļØ╝ņŖżĒü¼(spinner flask)(Fig. 3D)ņÖĆ ļĪżļ¤¼ ļ│┤ĒŗĆ(roller bottle)(Fig. 3E)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļīĆļ¤ēņ£╝ļĪ£ ņŖżĒÄśļĪ£ņØ┤ļō£ļź╝ ņĀ£ņ×æĒĢĀ ņłś ņ׳ļŖö ļ░®ļ▓Ģņ£╝ļĪ£ ņĀĢņĀüņØĖ ļ░░ņ¢æļ▓ĢņŚÉ ļ╣äĒĢ┤ ļÅÖņĀüņ£╝ļĪ£ ĒÜīņĀäĒĢśļŖö ļ░░ņ¢æņÜ®ĻĖ░ ņĢłņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ĆļŖö ņŖżĒÄśļĪ£ņØ┤ļō£ļŖö ņāüļīĆņĀüņ£╝ļĪ£ ĻĘĖ ļ¬©ņ¢æņŚÉ ņ׳ņ¢┤ ĻĘĀņØ╝ĒĢśļ®░ ļÅÖņŗ£ņŚÉ ļīĆļ¤ēņØś ņŖżĒÄśļĪ£ņØ┤ļō£ļź╝ ņĀ£ņ×æĒĢĀ ņłś ņ׳Ļ│Ā, Ēü¼ĻĖ░ ļśÉĒĢ£ ĒÜīņĀä ņåŹļÅäņÖĆ ņäĖĒżņĢĪņØś ņäĖĒżļåŹļÅäļź╝ ņĪ░ņĀłĒĢśņŚ¼ ļŗżņ¢æĒĢśĻ▓ī ņĀ£ņ×æĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ļŗż. ļ░śļ®┤ ĒÜīņĀä ĒöīļØ╝ņŖżĒü¼ņÖĆ Ļ░ÖņØ┤ ņłśĒÅēļ®┤ņ£╝ļĪ£ ĒÜīņĀäĒĢśļŖö ļ░░ņ¢æ ņÜ®ĻĖ░ņØś ĒÜīņĀäņåŹļÅäĻ░Ć ļäłļ¼┤ ļ╣Āļź┤Ļ▓ī ļÉśļ®┤ ņĀäļŗ©ļĀź(shear force)ņØ┤ Ļ░ĢĒĢ┤ņĀĖ ņäĖĒżņØś ņāØļ”¼ĒĢÖņĀü ļ░śņØæņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖö ļŗ©ņĀÉņØ┤ņ׳ļŗż[24,25]. ņĄ£ĻĘ╝ ļ»ĖĻĄŁņØś National Aeronautics and Space AdministrationņŚÉņä£ ņØ┤ļź╝ ļ│┤ņÖäĒĢśĻĖ░ ņ£äĒĢ┤ ņĀäļŗ©ļĀźņØä ļé«ņČöĻ│Ā, ļīĆņŗĀ ņżæļĀźņØä ļŹöĒĢ┤ ĻĄ¼ļź┤ļŖö ņÜ┤ļÅÖņ£╝ļĪ£ ĒÜīņĀäņØä ļīĆņŗĀĒĢ£ ļĪżļ¤¼ ļ│┤ĒŗĆņØä Ļ░£ļ░£ĒĢśņŚ¼ ĒÜīņĀä ĒöīļØ╝ņŖżĒü¼ļź╝ ļīĆņ▓┤ĒĢśĻ│Ā ņ׳ļŗż[26,27].
Ēæ£ļ®┤ņĪ░ņĀł ļ░░ņ¢æĻĖ░ ļśÉļŖö ņŖżņ║ÉĒÅ┤ļō£(surface modified substrates or scaffolds)
ņĄ£ĻĘ╝ ĻĖ░ļŖźĒÖöļÉ£ Ēæ£ļ®┤ņ×¼ļŻīļōżņØä ņØ┤ņÜ®ĒĢ£ ņŖżĒÄśļĪ£ņØ┤ļō£ ņĀ£ņ×æļ▓ĢļōżņØ┤ ņåīĻ░£ļÉśĻ│Ā ņ׳ļŗż. ļīĆĒæ£ņĀüņØĖ ņśłļĪ£ Ēæ£ļ®┤ņŚÉ ņ¢æņĀäĒĢśļź╝ ļØż Primaria dishes(BD Biosciences, Franklin Lakes, NJ, USA)(Fig. 3F)ļĪ£ ņäĖĒżļź╝ ļ░░ņ¢æĒĢśĻ▓ī ļÉśļ®┤ ļ░░ņ¢æ ņ┤łĻĖ░ņŚÉļŖö ņäĖĒżļōżņØ┤ Ēæ£ļ®┤ņŚÉ ļŗ©ņĖĄņ£╝ļĪ£ ĒŹ╝ņĀĖņä£ ļ░░ņ¢æļÉśļŗżĻ░Ć 48ņŗ£Ļ░ä ĒøäņŚÉļŖö actin filamentļź╝ ļ¦żĻ░£ļĪ£ ĒĢ£ ņĪ░ņ¦ü ņ×¼ĻĄ¼ņä▒ Ļ│╝ņĀĢņ£╝ļĪ£ ņäĖĒżļōżņØ┤ ĻĄ¼ņČĢ, ņØ┤ļÅÖĻ│╝ ņĀäņØ┤ņØś Ļ│╝ņĀĢņØä Ļ▒░ņ│É 2ņ░©ņøÉņĀüņØĖ ļŗ©ņĖĄĻĄ¼ņĪ░ņŚÉņä£ 3ņ░©ņøÉ ĻĄ¼ņ▓┤ļ¬©ņ¢æņØś ĻĄ¼ņĪ░ļĪ£ ļ¦ÉļĀżļōżĻ▓ī ļÉ£ļŗż. ņ£Āņé¼ĒĢ£ ņ×¼ļŻīļĪ£ galactosylated poly(vinylidene difluoride) ļśÉļŖö polyethylene terephthalate filmņØ┤ ņ׳ļŗż[28,29].
ņś©ļÅäņ░©ļź╝ ņØ┤ņÜ®ĒĢ£ ļ░®ļ▓Ģ ļśÉĒĢ£ ņåīĻ░£ļÉ£ ļ░ö ņ׳ļŖöļŹ░, thermosresponsive poly(N-isopropylacrylamide)ļĪ£ ņ▓śļ”¼ļÉ£ Ēæ£ļ®┤ņØś ļ░░ņ¢æņÜ®ĻĖ░ņŚÉ ņäĖĒżļź╝ ļ░░ņ¢æņŗ£Ēéżļ®┤ ņÜ®ĻĖ░ ļ░öļŗźņ£╝ļĪ£ļČĆĒä░ ļČĆņ£ĀĒĢśļŖö ļŗ©ņĖĄĻĄ¼ņĪ░ņØś ņäĖĒżņĖĄņØ┤ ĒśĢņä▒ļÉśĻ│Ā ļ░░ņ¢æņś©ļÅäļź╝ ļé«ņČöĻ▓ī ļÉśļ®┤ ņäĖĒżņĖĄņØś Ļ░Ćņןņ×Éļ”¼ļČĆĒä░ ļ¦ÉļĀżļō£ļŖö ņłśņČĢĒśäņāüņØ┤ ļ░£ņāØĒĢśņŚ¼ ĻĄ¼ņ▓┤ļ¬©ņ¢æņØś ņĪ░ņ¦üņØä ĒśĢņä▒ĒĢśĻ▓ī ļÉśļŖö ņøÉļ”¼ņØ┤ļŗż(Fig. 3G). ņāüĻĖ░ ļ░®ļ▓ĢļōżļĪ£ ļ¦īļōżņ¢┤ņ¦ä ņŖżĒÄśļĪ£ņØ┤ļō£ļŖö ņøÉņŗ¼ļČäļ”¼ļź╝ ĒåĄĒĢ┤ ņÜ®ĻĖ░ļĪ£ļČĆĒä░ ļČäļ”¼ĒĢ┤ļé╝ ņłś ņ׳ļŗż[30-32]. ĻĖ░ĒāĆ polyurethane foamņ£╝ļĪ£ ņĀ£ņ×æĒĢ£ ļŗżĻ│Ąņä▒ 3-D ņŖżņ║ÉĒÅ┤ļō£(porous 3-D scaffold)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņäĖĒżļōżņØś ņ×ÉĻ░Ć ņØæņ¦æņØä ļ¼╝ļ”¼ņĀüņ£╝ļĪ£ ņ¦Ćņ¦ĆĒĢśļŖö ļ░®ļ▓ĢļÅä ņ׳ļŗż[33,34].
ņÖĖļĀź(external forces)ņØä ņØ┤ņÜ®ĒĢ£ ņŖżĒÄśļĪ£ņØ┤ļō£ ņĀ£ņ×æ
ņĀĆņåŹ ņøÉņŗ¼ļČäļ”¼, ņ£ĀņĀäņśüļÅÖ(dielectrophoresis), ņ×Éņä▒(magnetic field) ļ░Å ņ┤łņØīĒīīļź╝ ņØ┤ņÜ®ĒĢ£ ĒŖĖļ×®(ultrasound standing wave trap)ņÖĆ Ļ░ÖņØĆ ļŗżņ¢æĒĢ£ ņÖĖļČĆņØś ĒלņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņäĖĒżņØæņ¦æļĀźņØä Ē¢źņāüņŗ£Ēé¼ ņłś ņ׳ņ£╝ļ®░ ņäĖĒż ņØæņ¦æņØ┤ ņÜ®ņØ┤ĒĢśņ¦Ć ņĢŖņØĆ Ļ░ĆĒś╣ĒĢ£ ņĪ░Ļ▒┤ņŚÉņä£ ņŖżĒÄśļĪ£ņØ┤ļō£ļź╝ ņĀ£ņ×æĒĢ┤ņĢ╝ ĒĢśļŖö Ļ▓ĮņÜ░ņŚÉ ļ│┤ņĪ░ņĀüņØĖ ļ░®ļ▓Ģņ£╝ļĪ£ ņé¼ņÜ®ļÉ£ļŗż(Fig. 3H)[35-37].
ņŖżĒÄśļĪ£ņØ┤ļō£ ņ╣®(spheroid on a chip)
ņĄ£ĻĘ╝ņŚÉļŖö ļīĆļ¤ēņØś ņāØņ▓┤ļ¬©ņé¼ņ▓┤ļź╝ ņØ┤ņÜ®ĒĢ£ ņĢĮļ¼╝ņŖżĒü¼ļ”¼ļŗØ ņŗżĒŚśņØä ņ£äĒĢ┤ ļ¦łņØ┤Ēü¼ļĪ£ņø░(microwell) ļśÉļŖö ļ¦łņØ┤Ēü¼ļĪ£ņ▒äļäÉņØä ņ╣®(chip)ņåŹņŚÉ ĒżĒĢ©ĒĢśņŚ¼ ņłśņ▓£ Ļ░£ņØś ņŖżĒÄśļĪ£ņØ┤ļō£ļź╝ ļÅÖņŗ£ņŚÉ ļ░░ņ¢æĒĢśļ®░ ņĢĮļ¼╝ ļśÉļŖö ļŗżņ¢æĒĢ£ ĒÖöĒĢÖļ¼╝ņ¦łņŚÉ ļīĆĒĢ£ ņäĖĒżļ░śņØæ, ņāØņĪ┤ņä▒Ļ│╝ ĒĢ┤ļÅģļ░śņØæņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļÅä ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[38,39].
ņŚ░ĻĄ¼ ļÅÖĒ¢ź ļ░Å Ļ▓░ļĪĀ
ļ│┤Ļ│ĀļÉ£ ņłś ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ ļ│┤ņŚ¼ņŻ╝ļō» ņŖżĒÄśļĪ£ņØ┤ļō£ļź╝ ĒżĒĢ©ĒĢ£ ņāØņ▓┤ļ¬©ņé¼ņ▓┤ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņāØļ”¼-ņØśĒĢÖļČäņĢ╝ņØś ņŻ╝ļÉ£ ņŚ░ĻĄ¼ ļ¬©ļŹĖņØ┤ ļÉśņ¢┤Ļ░ĆĻ│Ā ņ׳ļŗż. ļŹöļČłņ¢┤ Ļ│Ąņ┤łņĀÉ ļĀłņØ┤ņĀĖņŻ╝ņé¼Ēśäļ»ĖĻ▓Į(confocal laser scanning microscope), ļŗżņ¢æĒĢ£ ņĪ░ņśüņĀ£ļź╝ ņØ┤ņÜ®ĒĢ£ ļ¦łņØ┤Ēü¼ļĪ£ ņ×ÉĻĖ░Ļ│Ąļ¬ģĒśäļ»ĖĻ▓Į(micro-magnetic resonance microscopy), ņ¢æņĀäņ×Éļ░®ņČ£ļŗ©ņĖĄņ┤¼ņśü(positron-emission tomography)ļ░Å Ļ┤æĒĢÖļŗ©ņĖĄņ┤¼ņśüĻĖ░ļ▓Ģ(optical sectioning technology)ņØä ņØ┤ņÜ®ĒĢ£ ņŖżĒÄśļĪ£ņØ┤ļō£ ļé┤ļČĆņØś ļīĆņé¼(metabolism), ņäĖĒżņØś ņāØņĪ┤Ļ│╝ Ļ┤┤ņé¼(apoptosis)ņÖĆ Ļ░ÖņØĆ ņāØļ”¼ņ×æņÜ®ņØä ņŗ£Ļ░üĒÖöĒĢśņŚ¼ ņĖĪņĀĢĒĢĀ ņłś ņ׳ļŖö ņśüņāüĻĖ░ļ▓Ģļōż ļśÉĒĢ£ ļ╣Āļź┤Ļ▓ī ļ░£ņĀäĒĢśĻ│Ā ņ׳ļŗż[40-42]. ņØ┤ļ¤¼ĒĢ£ ĻĖ░ļ▓ĢļōżņØ┤ ņŖżĒÄśļĪ£ņØ┤ļō£ņØś ĻĖ░ļŖźņØä ĒÜ©ņ£©ņĀüņ£╝ļĪ£ Ē¢źņāüņŗ£ĒéżļŖö ļŗżņ¢æĒĢ£ ĻĖ░ļ▓ĢļōżĻ│╝ Ļ▓░ĒĢ®ļÉśņ¢┤ ņĪ░ņ¦üņØś ņāØņä▒, ļ│ĆĒÖöĻ│╝ņĀĢĻ│╝ ļéśņĢäĻ░Ć ņ£ĀņĀäņ×É ļ░£ĒśäņØä ņŗżņŗ£Ļ░äņ£╝ļĪ£ ņŗ£Ļ░üĒÖöĒĢĀ ņłś ņ׳ļŖö ņŚ░ĻĄ¼ļĪ£ ļ░£ņĀäĒĢ┤ ļéśĻ░ł Ļ▓āņØ┤ļ®░ ĻČüĻĘ╣ņĀüņ£╝ļĪ£ļŖö ņØĖĻ│ĄņןĻĖ░ ļśÉļŖö ņ×äņāüņĀüņ£╝ļĪ£ ņĀüņÜ®Ļ░ĆļŖźĒĢ£ ņØ┤ņŗØņ▓┤ Ļ░£ļ░£ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ņśłņāüļÉ£ļŗż.