 |
 |
AbstractBackground and ObjectivesThis study aimed to evaluate whether Toll-like receptors (TLRs) messenger ribonucleic acid (mRNA) were expressed in the facial nerve after incurring a crush or an injury of the facial nerve.
Materials and MethodAn adult Sprague-Dawley underwent a crush or injury of the unilateral facial nerve. The crush or injury was incurred by a cutting at the midpoint between the facial nerve trunk and its branch. The whisker movement of vibrissae muscle was examined 4 and 14 days after injury. Real-time polymerase chain reaction was performed for the normal facial nerve taken from the left side and the damaged nerve taken from the right side.
ResultsOn the 4th day of injury, the expression of TLR 9, 13 mRNA was significantly lower in the crush and injured groups than in the control group (p;<0.05). On the 14th day of injury, the expression of TLR 2 mRNA was significantly higher in the injured group than in the control group (p;<0.05).
ConclusionThe expressions of TLR 9, 13 mRNA in the distal facial nerve after injury in the crush and injured groups were significantly lower than that in the control group, but the expression of TLR 2 mRNA in the injured group was significantly higher. Therefore, TLRs may be involved in facial nerve damage and regeneration.
ņä£ ļĪĀļÅÖļ¼╝ņŚÉņä£ ļ░£Ļ▓¼ļÉśļŖö ņ£ĀĒśĢ ņØĖņŗØ ņłśņÜ®ņ▓┤(pattern recognition receptors, PRRs)ļŖö Ēå© ņ£Āņé¼ ņłśņÜ®ņ▓┤(Toll-like receptors, TLRs), nucleotide-binding and oligomerization domain (NOD) ņ£Āņé¼ ņłśņÜ®ņ▓┤(NOD-like receptors, NLRs), retinoic acid-inducible gene (RIG)-1 ņ£Āņé¼ ņłśņÜ®ņ▓┤(RIG-1 like receptors, RLRs), C-ĒśĢ ļĀēĒŗ┤ ņłśņÜ®ņ▓┤(C-type lectin receptors, CLRs)ņØś 4Ļ░Ćņ¦ĆĻ░Ć ļīĆĒæ£ņĀüņØ┤ļŗż[1,2]. ņĄ£ĻĘ╝ ļōżņ¢┤ ņäĀņ▓£ņä▒ ļ®┤ņŚŁļ░śņØæĻ│╝ Ļ┤ĆļĀ©ļÉśņ¢┤ ļŗżņ¢æĒĢ£ ņ¦łĒÖśņŚÉņä£ PRRsņØś ņŚŁĒĢĀņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒÖ£ļ░£Ē׳ ņ¦äĒ¢ē ņżæņŚÉ ņ׳ļŖöļŹ░ ĒŖ╣Ē׳ TLRsņŚÉ ļīĆĒĢ┤ ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ē ņżæņŚÉ ņ׳ļŗż.
TLRsļŖö ļģĖļ×æņ┤łĒīīļ”¼(Drosophila melanogaster)ņØś ļ░£ņāØĻ│╝ņĀĢņŚÉņä£ ļ░░ņĢäņØś ļō▒ļ░░ĻĘ╣ņä▒(dorsal-ventral embryonic polarity)ņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ņłśņÜ®ņ▓┤ļĪ£ ņ▓śņØī ļ░£Ļ▓¼ļÉśņŚłļŗż. ņé¼ļ×īņŚÉĻ▓īļŖö 10ņóģ, ņźÉ(mouse)ņŚÉļŖö 13ņóģņØ┤ ņ׳ļŗż. TLRsļŖö ļ░ĢĒģīļ”¼ņĢä, ļ░öņØ┤ļ¤¼ņŖż, ņ¦äĻĘĀ ļ░Å ņøÉņāØļÅÖļ¼╝ņØä Ļ░Éņ¦ĆĒĢśņŚ¼ ņäĀņ▓£ņä▒ ļ®┤ņŚŁļ░śņØæņØä ņØ╝ņ£╝ĒéżļŖöļŹ░, Ļ░üĻ░üņØś TLRsļŖö ņĪ┤ņ×¼ĒĢśļŖö ļČĆņ£äņŚÉ ļö░ļØ╝ ņä£ļĪ£ ļŗżļźĖ ļ│æņøÉņ▓┤ ņŚ░Ļ┤Ć ļČäņ×Éņ£ĀĒśĢ(pathogen-associated molecular patterns, PAMPs)ņØä ņØĖņŗØĒĢ£ļŗż. TLRsņŚÉ Ļ▓░ĒĢŹņØ┤ ļ░£ņāØĒĢśļ®┤ ņØ┤ļ¤¼ĒĢ£ ļ│æņøÉņ▓┤ļź╝ ņØĖņŗØĒĢśņ¦Ć ļ¬╗ĒĢ┤ ļŗżņ¢æĒĢ£ Ļ░ÉņŚ╝ņä▒ ļ®┤ņŚŁņ¦łĒÖśņØ┤ ņ£ĀļÅäļÉśĻ│Ā, ļ╣äņĀĢņāüņĀüņØĖ TLRs ļ░śņØæņØĆ ņżæņØ┤ņŚ╝, ņ▓£ņŗØ, ļÅÖļ¦źĻ▓ĮĒÖöņ”Ø, ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖś, ļ®┤ņŚŁ Ļ▓░ĒĢŹ, Ēī©Ēśłņ”Ø ļō▒ņØś ņ¦łļ│æĻ│╝ļÅä Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗż[3-5].
TLRsļŖö ņŻ╝ļĪ£ B ņäĖĒż, T ņäĖĒż, ļīĆņŗØņäĖĒż(macrophage) ļō▒Ļ│╝ Ļ░ÖņØĆ ļ®┤ņŚŁņäĖĒżņŚÉ ņĪ┤ņ×¼ĒĢśņŚ¼ ņäĀņ▓£ņä▒ ļ®┤ņŚŁļ░śņØæņØś ņŗĀĒśĖņĀäļŗ¼Ļ│╝ņĀĢņØä ĒÖ£ņä▒ĒÖöĒĢśļŖö ņŚŁĒĢĀņØä ĒĢśņ¦Ćļ¦ī ļ®┤ņŚŁņäĖĒżĻ░Ć ņĢäļŗī ņāüĒö╝ņäĖĒż, ĒśłĻ┤Ć ļé┤Ēö╝ ņäĖĒżņŚÉņä£ļÅä ļ░£ĒśäļÉśļ®░, ĒŖ╣Ē׳ ņĄ£ĻĘ╝ņŚÉļŖö ņżæņČöņŗĀĻ▓ĮĻ│äņØś ļ»ĖņäĖņĢäĻĄÉņäĖĒż(microglia), ņä▒ņāüņäĖĒż(astrocyte), ļē┤ļ¤░(neuron) ļō▒ņŚÉņä£ņØś ļ░£ĒśäļÅä ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. ņŗĀĻ▓ĮĻ│äņØś TLRsļŖö ļ│æņøÉņ▓┤ ņŚ░Ļ┤Ć ļČäņ×Éņ£ĀĒśĢ(PAMPs)ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņŗĀĻ▓Į ņåÉņāü Ēøä ņāØņä▒ļÉśļŖö ļé┤ņØĖņä▒ ņåÉņāü ņŚ░Ļ┤Ć ļČäņ×Éņ£ĀĒśĢ(damage-associated molecular patterns, DAMPs)ņØ┤ļéś ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æ(AlzheimerŌĆÖs disease)ņØś ņĢäļ░ĆļĪ£ņØ┤ļō£ ļ▓ĀĒāĆ(amyloid beta) Ļ░ÖņØĆ ļŗ©ļ░▒ņ¦łņŚÉ ņØśĒĢ┤ņä£ļÅä ĒÖ£ņä▒ĒÖöļÉśņ¢┤ ņŗĀĻ▓ĮņØś ņåÉņāüĻ│╝ ņ×¼ņāØ Ļ│╝ņĀĢņŚÉ Ļ┤ĆļĀ©ļÉ£ ņŗĀĒśĖ ņĀäļŗ¼ Ļ│╝ņĀĢņŚÉ Ļ┤ĆņŚ¼ĒĢśĻ▓ī ļÉ£ļŗż[6,7]. ĒŖ╣Ē׳ TLR 4ļŖö ņżæņČöņŗĀĻ▓ĮĻ│╝ ļ¦Éņ┤łņŗĀĻ▓ĮņŚÉņä£ ņŗĀĻ▓Į ņåÉņāü ņŗ£ņŚÉ ņŗĀĻ▓ĮņĀäĻĄ¼ņäĖĒż(neuronal progenitor cell)ņØś ņ”ØņŗØņØä ņ¢ĄņĀ£ĒĢśĻ│Ā, ņŗĀĻ▓Įļ│Ćņä▒(neurodegeneration)ņØä ņ┤ēņ¦äĒĢśļŖö ņŚŁĒĢĀņØä ĒĢ£ļŗżļŖö Ļ▓āņØ┤ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ļ│┤Ļ│ĀļÉśņŚłļŗż[6,8].
ļ¦Éņ┤łņŗĀĻ▓ĮņŚÉ ļ░£ņāØĒĢśļŖö ņ¦łĒÖśņØĖ ņĢłļ®┤ļ¦łļ╣äļŖö ņāØļ¬ģņØä ņ£äĒśæĒĢśļŖö ņ¦łĒÖśņØĆ ņĢäļŗłņ¦Ćļ¦ī, ĒÜīļ│ĄņØ┤ ļČłņÖäņĀäĒĢĀ Ļ▓ĮņÜ░ ņŗ¼ļ”¼ņĀü, ņĀĢņä£ņĀü, ĻĘĖļ”¼Ļ│Ā ņé¼ĒÜīņĀüņ£╝ļĪ£ ņéČņØś ņ¦łņØä ļ¦ÄņØ┤ ļ¢©ņ¢┤ļ£©ļĀż ĒÖśņ×ÉņØś ņé¼ĒÜīĒÖ£ļÅÖņŚÉ ļ¦żņÜ░ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŖö ņ¦łĒÖśņØ┤ļ»ĆļĪ£ ļ¼┤ņŚćļ│┤ļŗż ņÖäņ╣śĻ░Ć ņżæņÜöĒĢśļŗż[9,10]. ļŗżņ¢æĒĢ£ ņøÉņØĖņØś ņĢłļ®┤ļ¦łļ╣ä ĒÖśņ×ÉļōżņŚÉņä£ ņÖäņ╣śļź╝ ņ£äĒĢ┤ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśĻ│Ā ņ׳ņ¦Ćļ¦ī ņĢäņ¦üĻ╣īņ¦Ć ņĢłļ®┤ļ¦łļ╣äņŚÉ ĒŖ╣ņØ┤ņĀüņØĖ ļ░öņØ┤ņśżļ¦łņ╗ż(biomarker)Ļ░Ć ņŚåĻ│Ā, ņĢłļ®┤ņŗĀĻ▓Į ņ×¼ņāØņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖö ņāØļ¼╝ĒĢÖņĀü ņØĖņ×ÉļōżņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļÅä ļŗżļźĖ ļČäņĢ╝ņŚÉ ļ╣äĒĢ┤ņä£ļŖö ņ¦Ćņ¦Ć ļČĆņ¦äĒĢ£ ņāüĒā£ņØ┤ļŗż. ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ļŖö ņĢłļ®┤ņŗĀĻ▓ĮņØś ņåÉņāü ļ░Å ņ×¼ņāØņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ņāØļ¼╝ĒĢÖņĀü ņØĖņ×ÉļōżņØä ĒāÉĻĄ¼ĒĢśĻ│Āņ×É, ņĢłļ®┤ļ¦łļ╣ä ļÅÖļ¼╝ļ¬©ļŹĖņØä ĻĄ¼ĒśäĒĢśņŚ¼ ņĢłļ®┤ņŗĀĻ▓Į ņåÉņāü Ēøä ņåÉņāü ņøÉņ£äļČĆņŚÉņä£ TLRsņØś messenger ribonucleic acid (mRNA)ņØś ļ░£Ēśäņ¢æņāüņØä ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ņ×¼ļŻī ļ░Å ļ░®ļ▓ĢļīĆ ņāüņ▓┤ņżæ 200-250 g ļé┤ņÖĖņØś ņä▒ņłÖĒĢ£ ņłśņ╗Ę Sprague-Dawley (S-D)ļź╝ ņĢĢļ░ĢĻĄ░ 10ļ¦łļ”¼, ņĀłļŗ©ĻĄ░ 9ļ¦łļ”¼, ņ┤Ø 19ļ¦łļ”¼ļź╝ 1ņŻ╝Ļ░äņØś Ļ▓ĆņŚŁĻ│╝ ņĀüņØæĻĖ░Ļ░äņØä Ļ▒░ņ╣£ Ēøä ņŗżĒŚśļÅÖļ¼╝ Ļ┤Ćļ”¼ ņ¦Ćņ╣©ņŚÉ ļö░ļØ╝ ņé¼ņ£ĪĒĢśņśĆļŗż. ļīĆņĪ░ĻĄ░ņØĆ ņåÉņāüļÉ£ ļ░śļīĆņ¬Į ņĀĢņāü ņĢłļ®┤ņŗĀĻ▓Įņ£╝ļĪ£ ņŗżĒŚśĒĢśņśĆļŗż.
Ļ│╝ ņĀĢļ¬©ļōĀ ņŗżĒŚśļÅÖļ¼╝ļōżņØĆ 80% ņé░ņåīņŚÉ Ēś╝ĒĢ®ļÉ£ 5% isoflurane (Forane solution; Choongwae Pharma, Seoul, Korea)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒØĪņ×ģļ¦łņĘ©ļź╝ ņ£ĀļÅäĒĢśĻ│Ā 2% isoflurane (Choongwae Pharma, Seoul, Korea)ņ£╝ļĪ£ ļ¦łņĘ©ļź╝ ņ£Āņ¦ĆĒĢśņśĆļŗż. ĒØĪņ×ģ ļ¦łņĘ©ļÉ£ S-D ratņØś ņÜ░ņĖĪ ļ©Ėļ”¼ ļČĆļČäņŚÉ ĒøäņØ┤Ļ░£ ņĀłĻ░£(post-auricular incision)ļź╝ Ļ░ĆĒĢśņŚ¼ ņ£Āņ¢æļÅīĻĖ░ļČĆ(mastoid process)ņÖĆ ņØ┤ĒĢśņäĀ(parotid gland)ņØä ĒÖĢņØĖ Ēøä, ņĢłļ®┤ņŗĀĻ▓Į ņ▓┤Ļ░ä(facial nerve trunk)Ļ│╝ 5Ļ░£ņØś ļČäņ¦Ć(temporal, zygomatic, buccal, mandibular, cervical branch)ļź╝ ļģĖņČ£ņŗ£ņ╝░ļŗż. Zeiss microscope (Carl Zeiss, Jena, Germany)ĒĢś Ļ▓Įņ£ĀļÅīĻ│Ą(stylomastoid foramen)ņŚÉņä£ ņĢłļ®┤ņŗĀĻ▓Į ņ▓┤Ļ░äņØ┤ ļéśņśżļŖö ļČĆņ£äņÖĆ ņĢłļ®┤ņŗĀĻ▓ĮņØ┤ ļČäņ¦ĆĒĢśļŖö ļČĆņ£äņØś ņżæĻ░ä ņ¦ĆņĀÉņŚÉ ņåÉņāüņØä ņŻ╝ņŚłļŗż. ņĢĢļ░ĢĻĄ░ņØĆ Ļ▓¼ņØĖ(traction) ļō▒ņŚÉ ņØśĒĢ£ ņåÉņāü Ļ░ĆļŖźņä▒ņØä ņżäņØ┤Ļ│Ā ņŗĀĻ▓ĮņØś ļüŖņ¢┤ņ¦ÉņØä ļ░®ņ¦ĆĒĢśĻĖ░ ņ£äĒĢ┤, ņĢłļ®┤ņŗĀĻ▓ĮņØä jewelerŌĆÖs forcepņ£╝ļĪ£ ņ×ĪĻ│Ā ļŗżļźĖ forcepņ£╝ļĪ£ ņĢłļ®┤ņŗĀĻ▓ĮņØä ņ×ĪĻ│Ā ņ׳ļŖö jewelerŌĆÖs forcepņØä ļłäļź┤ļŖö Ļ░äņĀæņĀü ļ░®ņŗØņ£╝ļĪ£ 30ņ┤łĻ░ä ņĢĢļ░ĢĒĢśņśĆņ£╝ļ®░, ņĀłļŗ©ĻĄ░ņØĆ scissorsļĪ£ ņÖäņĀä ņĀłļŗ©ĒĢ£ Ēøä ņāüņ▓śļČĆņ£äļź╝ ļ┤ēĒĢ®ĒĢśņŚ¼ ļ¦łņĘ©ņŚÉņä£ ĒÜīļ│Ąņŗ£ņ╝░ļŗż(Fig. 1). ņĢłļ®┤ņŗĀĻ▓ĮņØś ĻĖ░ļŖźņØĆ ņĮ¦ņłśņŚ╝ņØś ņÜ┤ļÅÖ(whisker movement of vibrissae muscle)ņØä Ļ▓Ćņé¼ĒĢśļŖö ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÅēĻ░ĆĒĢśņśĆļŗż(Table 1). ņĮ¦ņłśņŚ╝ņØś ņøĆņ¦üņ×äņØä ļ╣äļööņśżļĪ£ ņ┤¼ņśüĒĢśņŚ¼ ņŗżĒŚśņŚÉ Ļ░Ćļŗ┤ĒĢśņ¦Ć ņĢŖņØĆ 2ļ¬ģņØś ņé¼ļ×īņŚÉĻ▓ī ņøĆņ¦üņ×äņØś ņĀĢļÅäļź╝ ĒÅēĻ░ĆĒĢśņŚ¼ ņĀÉņłśļź╝ ĻĖ░ļĪØĒĢśĻ▓ī ĒĢ£ Ēøä ĒÅēĻĘĀņØä ņĖĪņĀĢĒĢśņśĆļŗż. ĒÅēĻ░Ć ĻĖ░ņżĆņØĆ ņłśņŚ╝ņØś ņøĆņ¦üņ×äņØ┤ ņĀäĒśĆ ņŚåņ£╝ļ®┤ 1, ņłśņŚ╝ņØś ĒĢśļ░®ņŚÉņä£ ņÜöļÅÖņØ┤ ņ׳ņ¢┤ņä£ ņłśņŚ╝ ļ¬©ļéŁņ£╝ļĪ£ļČĆĒä░ņØś ņøĆņ¦üņ×äņ£╝ļĪ£ ĒĢ┤ņäØļÉśļŖö Ļ▓ĮņÜ░ļŖö 2, ņĀäņ▓┤ ĻĖĖņØ┤ņŚÉ Ļ▒Ėņ│Éņä£ ņØ╝ļČĆ ņłśņŚ╝ņØ┤ ņøĆņ¦üņØ┤ļ®┤ 3, ļ¬©ļōĀ ņłśņŚ╝ņØ┤ ņøĆņ¦üņØ┤ļ®┤ 4, ņåÉņāüņŗ£Ēéżņ¦Ć ņĢŖņØĆ ļ░śļīĆņ¬ĮĻ│╝ ņÖäņĀä ļÅÖņØ╝ĒĢśĻ▓ī ņøĆņ¦üņØ╝ Ļ▓ĮņÜ░ 5ļĪ£ ĻĖ░ļĪØĒĢśņśĆļŗż[11,12]. ņÖłļ¤¼ļ│Ćņä▒(Wallerian degeneration)ņØ┤ ņ¦äĒ¢ēļÉśļŖö ņåÉņāü Ēøä 4ņØ╝ņ¦ĖņÖĆ ņŗĀĻ▓Į ņ×¼ņāØņØ┤ ņ¦äĒ¢ēļÉśļŖö 14ņØ╝ņ¦ĖņŚÉ Ļ░üĻ░ü ņĮ¦ņłśņŚ╝ņØś ņÜ┤ļÅÖņØä Ļ▓Ćņé¼ĒĢśņśĆĻ│Ā, ĒØĪņ×ģļ¦łņĘ© ņāüĒā£ņŚÉņä£ ņóīņĖĪņØś ņĀĢņāü ņĢłļ®┤ņŗĀĻ▓ĮĻ│╝ ņÜ░ņĖĪņØś ņåÉņāüļÉ£ ņĢłļ®┤ņŗĀĻ▓ĮņØä ņ▒äņĘ©ĒĢśņŚ¼ TLR 1-13ņŚÉ ļīĆĒĢ┤ ņŗżņŗ£Ļ░ä ņżæĒĢ®ĒÜ©ņåī ņŚ░ņćäļ░śņØæ(real-time polymerase chain reaction [PCR])ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż[13]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņŗ£Ē¢ēļÉ£ ļ¬©ļōĀ ņŗżĒŚśņØĆ ļ│ĖņøÉ ņ×äņāü ņŗ£ĒŚś ņŗ¼ņé¼ ņ£äņøÉĒÜīņØś ņŖ╣ņØĖņØä ļ░øņĢä ņŗ£Ē¢ēĒĢśņśĆļŗż(KHMC-IACUC 21-005).
RNA ņČöņČ£Ļ│╝ ņŗżņŗ£Ļ░ä ņżæĒĢ®ĒÜ©ņåī ņŚ░ņćäļ░śņØæ(real-time PCR)ņ▒äņĘ©ļÉ£ ņĢłļ®┤ņŗĀĻ▓Įņ£╝ļĪ£ļČĆĒä░ ļ¬©ļōĀ RNAļź╝ ņČöņČ£ĒĢśĻĖ░ ņ£äĒĢ┤, ņĀ£ņĪ░ņé¼ņØś ĒöäļĪ£ĒåĀņĮ£ņŚÉ ļö░ļØ╝ TRIzol solution (Invitrogen, Carlsbad, CA, USA)ņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņČöņČ£ĒĢ£ RNAņØś 1 ╬╝gņØä random hexamers (Promega, Madison, WI, USA)ņÖĆ ņŚŁņĀäņé¼ ņŗ£ņŖżĒģ£ņØä ņØ┤ņÜ®ĒĢśņŚ¼ cDNAļĪ£ ņĀäņé¼ņŗ£ņ╝░ļŗż. ņé¼ņÜ®ĒĢ£ primerņØś ņŚ╝ĻĖ░ņä£ņŚ┤ņØĆ Table 2ņŚÉ Ēæ£ĻĖ░ĒĢśņśĆļŗż. Real-time PCRņØĆ StepOnePlus Real-Time PCR SystemĻ│╝ Power SYBR Green PCR Master Mix (Applied Biosystems, Foster City, CA, USA)ļĪ£ ņŗ£Ē¢ēĒĢśņśĆļŗż. 2 ╬╝LņØś cDNA, 10 ╬╝LņØś Power SYBR Green PCR Master Mix, 2 ╬╝LņØś primers, ĻĘĖļ”¼Ļ│Ā 7 ╬╝LņØś PCR-grade waterļĪ£ ĻĄ¼ņä▒ļÉ£ 20 ╬╝LņØś ļ░śņØæ Ēś╝ĒĢ®ļ¼╝ļĪ£ PCRņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ┤ Ēś╝ĒĢ®ļ¼╝ņØä 95┬░CņŚÉņä£ 10ļČäĻ░ä ļ│Ćņä▒ņŗ£ņ╝░ņ£╝ļ®░, 95┬░CņŚÉņä£ 15ņ┤ł Ēøä 60┬░CņŚÉņä£ 1ļČäņØä 1 cycleļĪ£ ĒĢśņŚ¼ 40 cycleņØä ņŗ£Ē¢ēĒĢśņŚ¼ ņ”ØĒÅŁĒĢśņśĆļŗż. Ļ░ü TLRsņØś Ļ▓ĆņČ£ļ¤ēņØĆ ╬▓-actinĻ│╝ Ēæ£ņĀü ņ£ĀņĀäņ×ÉņØś ĻĄÉņ░©ņĀÉņØä 2-(target gene-╬▓-actin)ļØ╝ļŖö Ļ│ĄņŗØņØä ņé¼ņÜ®ĒĢśņŚ¼ Ļ│äņé░ĒĢśņśĆļŗż.
ĒåĄĻ│ä ļČäņäØļ¬©ļōĀ ņŗżĒŚśĻ▓░Ļ│╝ļŖö ĒÅēĻĘĀĻ│╝ Ēæ£ņżĆņśżņ░©ļź╝ ņé░ņČ£ĒĢśĻ│Ā ĻĘĖļŻ╣ Ļ░ä ĒÅēĻĘĀ ļ╣äĻĄÉļŖö one-way analysis of varianceļĪ£ ļČäņäØĒĢ£ Ēøä scheffe Ļ▓ĆņĀĢļ▓Ģņ£╝ļĪ£ ņé¼Ēøä Ļ▓Ćņ”ØĒĢśņśĆņ£╝ļ®░, p’╝£0.05ļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØä ĒÅēĻ░ĆĒĢśņśĆļŗż. Ļ▓░Ļ│╝ņ╣śļŖö ĒÅēĻĘĀ┬▒Ēæ£ņżĆņśżņ░©(standard error)ļĪ£ Ēæ£ĻĖ░ĒĢśņśĆļŗż.
Ļ▓░ Ļ│╝ņĮ¦ņłśņŚ╝ņØś ņÜ┤ļÅÖ(whisker movement of vibrissae muscle) Ļ▓Ćņé¼ņĢłļ®┤ņŗĀĻ▓Į ņåÉņāü Ēøä 4ņØ╝ņ¦ĖņŚÉļŖö ļīĆņĪ░ĻĄ░ņØś ņĀÉņłśĻ░Ć 5ņØĖ ļ░śļ®┤ ņĢĢļ░ĢĻĄ░ņŚÉņä£ļŖö 2.60┬▒0.89, ņĀłļŗ©ĻĄ░ņŚÉņä£ļŖö 1.80┬▒0.45ļĪ£ ņĀłļŗ©ĻĄ░ņŚÉņä£ Ļ░Ćņן ļéśņü£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņĢłļ®┤ņŗĀĻ▓Į ņåÉņāü Ēøä 14ņØ╝ņ¦ĖņŚÉļÅä ļīĆņĪ░ĻĄ░ņØś ĒÅēĻĘĀ ņĀÉņłśļŖö 5ņØĖ ļ░śļ®┤ ņĢĢļ░ĢĻĄ░ņŚÉņä£ļŖö 1.60┬▒0.55, ņĀłļŗ©ĻĄ░ņŚÉņä£ļŖö 1.25┬▒0.50ļĪ£ ņĀłļŗ©ĻĄ░ņŚÉņä£ Ļ░Ćņן ļéśņü£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆĻ│Ā, ņĢĢļ░ĢĻĄ░Ļ│╝ ņĀłļŗ©ĻĄ░ņØĆ Ļ░ü ĻĄ░ņØś 4ņØ╝ņ¦Ė ņĀÉņłśņŚÉ ļ╣äĒĢ┤ 14ņØ╝ ņ¦ĖņŚÉ ļŹö ļéśņü£ ņĀÉņłśļź╝ ļ│┤ņśĆļŗż(p’╝£0.05)(Fig. 2).
TLR 1~13 mRNAņØś ļ░£Ēśä ņ¢æņāüņåÉņāü 4ņØ╝ņ¦Ė, ņĢĢļ░ĢĻĄ░Ļ│╝ ņĀłļŗ©ĻĄ░ņŚÉņä£ TLR 2, 6, 7 mRNAņØś ļ░£ĒśäņØ┤ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ļŹö ļ¦ÄņĢśļŗż. ņåÉņāü 14ņØ╝ņ¦Ė, ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņĢĢļ░ĢĻĄ░ņŚÉņä£ļŖö TLR 2, 6, 7 mRNAņØś ļ░£ĒśäņØ┤ ļ¦ÄņĢśņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦ĆļŖö ņĢŖņĢśĻ│Ā, ņĀłļŗ©ĻĄ░ņŚÉņä£ļŖö TLR 1-7, 9, 10 mRNAņØś ļ░£ĒśäņØ┤ ļ¦ÄņĢśņ£╝ļéś TLR 2 mRNAļź╝ ņĀ£ņÖĖĒĢśĻ│ĀļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(Fig. 3).
ņåÉņāü 4ņØ╝ņ¦Ė, ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņĢĢļ░ĢĻĄ░Ļ│╝ ņĀłļŗ©ĻĄ░ņŚÉņä£ TLR 9, 13 mRNAņØś ļ░£ĒśäņØ┤ ņ£ĀņØśĒĢśĻ▓ī ņĀüņŚłļŗż(p’╝£0.05). ņåÉņāü 14ņØ╝ņ¦ĖļŖö ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņĀłļŗ©ĻĄ░ņŚÉņä£ TLR 2 mRNAņØś ļ░£Ēśäļ¦ī ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(p’╝£0.05) (Fig. 3).
Ļ│Ā ņ░░ņŗĀĻ▓ĮņØ┤ ņĀłļŗ©ļÉśļ®┤ ņåÉņāüļÉ£ ņŗĀĻ▓ĮņØś ņøÉņ£äļČĆņŚÉņä£ ņÖłļ¤¼ļ│Ćņä▒ņØ┤ļØ╝ļŖö ļ│ĆĒÖöĻ░Ć ņŗ£ņ×æļÉ£ļŗż. ņÖłļ¤¼ļ│Ćņä▒ņŚÉļŖö ļīĆņŗØņäĖĒż(macrophage)ņÖĆ ņŖłļ░śņäĖĒż(schwann cell)Ļ░Ć ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļ®░, ņåÉņāüļÉ£ ņŗĀĻ▓ĮņØś ņøÉņ£äļČĆņŚÉņä£ ņłśņ┤ł(myelin)ļź╝ ļČäĒĢ┤ĒĢśĻ│Ā ĒāÉņŗØņ×æņÜ®(phagocytosis)ņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢ£ļŗż. ļśÉĒĢ£ ņŖłļ░śņäĖĒżĻ░Ć c-Jun, Notch, Sox-2 ļō▒ņØś ņØīņä▒ ņĀäņé¼ ņĪ░ņĀłņ×É(negative transcriptional regulator)ņŚÉ ņØśĒĢ┤ ĒāłļČäĒÖö(dedifferentiation)ļÉśļ®┤ņä£ Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ņŗĀĻ▓Į ņ×¼ņāØ Ļ│╝ņĀĢņØ┤ ņØ╝ņ¢┤ļé£ļŗż[14-16]. ņŗĀĻ▓ĮņØ┤ ņåÉņāüļÉ£ Ēøä ņČĢņéŁ(axon) Ēć┤ĒÖöļĪ£ ņØĖĒĢ£ ļČĆņé░ļ¼╝ņØĖ ļé┤ņØĖņä▒ ņåÉņāü ņŚ░Ļ┤Ć ļČäņ×Éņ£ĀĒśĢ(DAMPs)ņØ┤ ņāØņä▒ļÉśļ®┤ ņŖłļ░śņäĖĒżņŚÉņä£ TLR 2-4, myeloid differentiation primary response 88 ļō▒ņØ┤ ĒÖ£ņä▒ĒÖöļÉśļ®░ ņØ┤ļōżņØĆ Tumor necrosis factor-╬▒, interleukin-1 (IL-1), monocyte chemoattractant protein-1 (MCP-1)ņØä ĒÖ£ņä▒ĒÖöņŗ£Ēé©ļŗż. MCP-1ņØĆ ļŗżņŗ£ phospholipase A2 (PLA2)ļź╝ ņ×ÉĻĘ╣ĒĢśĻ│Ā, PLA2ņŚÉ ņØśĒĢ┤ lysophosphatidylcholine (LPC)Ļ░Ć ņ×ÉĻĘ╣ļÉśņ¢┤ ņŖłļ░śņäĖĒżĻ░Ć ļ»ĖņŚśļ”░(myelin)ņØä ņ¦üņĀæ ļČäĒĢ┤ĒĢ£ļŗż. ļśÉĒĢ£ LPCļŖö macrophage inflammatory protein-1╬▒ (MIP-1╬▒)ņØä ļ░£Ēśäņŗ£ĒéżļŖöļŹ░, MIP-1╬▒ņŚÉ ņØśĒĢ┤ IL-1╬▓Ļ░Ć ļ¦Éņ┤łņŗĀĻ▓ĮņØś ņŖłļ░śņäĖĒżņŚÉņä£ ņåÉņāü 3ņØ╝ ņØ┤ļé┤ņŚÉ ļČäļ╣äļÉ£ļŗż. ņØ┤Ēøä ņŗĀĻ▓ĮņåÉņāü 3-7ņØ╝ņŚÉ ļ¦Éņ┤łņŗĀĻ▓ĮņØś ņŖłļ░śņäĖĒżņŚÉņä£ ļČäļ╣äļÉ£ IL-1╬▓, MCP-1, MIP-1╬▒ņŚÉ ņØśĒĢ┤ ļīĆņŗØņäĖĒżĻ░Ć ĒÖ£ņä▒ĒÖöļÉśņ¢┤ ļ»ĖņŚśļ”░ņØä ĒāÉņŗØņ×æņÜ®ņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢ£ļŗż[17-19].
ĻĖ░ņĪ┤ņŚÉ ņĢīļĀżņ¦ä ņŗĀĻ▓Į ņåÉņāü ņŗ£ ļ░£ņāØĒĢśļŖö ņŖłļ░śņäĖĒżņØś ņŗĀĒśĖņĀäļŗ¼Ļ▓ĮļĪ£ņŚÉļŖö TLR 2-4Ļ░Ć Ļ┤ĆļĀ©ņØ┤ ļÉ£ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ¦Ćļ¦ī, ņåÉņāü Ēøä ņŖłļ░śņäĖĒżņŚÉņä£ TLRs 1-9 mRNAĻ░Ć ļīĆļČĆļČä ļ░£ĒśäņØ┤ ņ”ØĻ░ĆĒĢ£ļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ļŗż. ņåÉņāü ņĀäņŚÉļŖö TLR 3, 4, 7 mRNAĻ░Ć ļåÆĻ▓ī ļ░£ĒśäļÉśĻ│Ā, ņåÉņāü ĒøäņŚÉļŖö TLR 1 mRNAĻ░Ć ĒŖ╣Ē׳ ļåÆĻ▓ī ļ░£ĒśäļÉśļŖöļŹ░ ņØ┤ļź╝ ĒåĄĒĢ┤ TLR 3, 4, 7ņØĆ ĒÅēņāüņŗ£ņŚÉ ļ®┤ņŚŁ Ļ░Éņŗ£(immune surveillance)ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśĻ│Ā, TLR 1ņØĆ ņŗĀĻ▓Į ņåÉņāüĻ│╝ Ļ░ÖņØĆ ņŖżĒŖĖļĀłņŖż ņāüĒā£ņŚÉņä£ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[20]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö TLR 1-13 mRNAļź╝ ļ¬©ļæÉ ļČäņäØĒĢśņśĆņ¦Ćļ¦ī ņĢłļ®┤ņŗĀĻ▓ĮņØä ņ▒äņĘ© Ēøä ņŖłļ░śņäĖĒżļéś ņÜ┤ļÅÖļē┤ļ¤░ ļō▒ ņäĖĒż ļŗ©ņ£äļĪ£ ļéśļłĀņä£ ļČäņäØĒĢśņ¦ĆļŖö ļ¬╗ĒĢśņśĆļŗż. ĒĢśņ¦Ćļ¦ī ņĢ×ņäĀ ņŚ░ĻĄ¼ņÖĆ ņ£Āņé¼ĒĢśĻ▓ī ņŗĀĻ▓ĮņåÉņāü Ēøä ļ¬©ļōĀ TLR mRNAĻ░Ć ļ░£ĒśäņØ┤ ļÉśņŚłļŗż. ĒŖ╣Ē׳ ņĢĢļ░Ģ ņåÉņāüņØś Ļ▓ĮņÜ░ TLR 1, 3-5, 8-13 mRNAļŖö Ļ░ÉņåīĒĢśņśĆĻ│Ā, TLR 2, 6, 7 mRNAļŖö ņ”ØĻ░ĆĒĢśņśĆļŗż. ņĀłļŗ© ņåÉņāüņØś Ļ▓ĮņÜ░ TLR 8, 11-13 mRNAļŖö Ļ░ÉņåīĒĢśņśĆĻ│Ā, TLR 1, 3-5, 9, 10 mRNAĻ░Ć 4ņØ╝ņ¦Ė Ļ░ÉņåīĒĢśņśĆļŗżĻ░Ć 14ņØ╝ņ¦Ė ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, TLR 2, 6, 7 mRNAļŖö ņ”ØĻ░ĆĒĢśņśĆļŗż. ņĢĢļ░Ģ ņåÉņāüĻ│╝ ņĀłļŗ© ņåÉņāüņØĆ Ļ│ĄĒåĄņĀüņ£╝ļĪ£ TLR 8, 11-13 mRNAĻ░Ć Ļ░ÉņåīĒĢśņśĆĻ│Ā, TLR 2, 6, 7 mRNAļŖö ņ”ØĻ░ĆĒĢśņśĆļŗż. ņ”ē, ņĢłļ®┤ņŗĀĻ▓Į ņåÉņāü Ēøä TLRs mRNAļŖö ļ¬©ļæÉ ļ░£ĒśäņØ┤ ļÉśņŚłņ¦Ćļ¦ī ņĢłļ®┤ņŗĀĻ▓ĮņØś ņåÉņāü ļ░®ļ▓ĢĻ│╝ ņåÉņāü Ēøä ņŗ£ĻĖ░ņŚÉ ļö░ļØ╝ ņä£ļĪ£ ļŗżļźĖ TLRsĻ░Ć ņ”ØĻ░ĆĒĢśĻ▒░ļéś Ļ░ÉņåīĒĢ©ņØä ņĢī ņłś ņ׳ņŚłļŗż.
ņĢłļ®┤ņŗĀĻ▓Į ņåÉņāü ļ░®ļ▓ĢņŚÉ ļö░ļØ╝ ļ░£ĒśäļÉśļŖö TLRņØś ņóģļźśĻ░Ć ļŗżļźĖ Ļ▓āņØĆ ņåÉņāü Ēøä ņĪ░ņ¦üĒĢÖņĀü ļ│ĆĒÖöņØś ņ░©ņØ┤Ļ░Ć ņøÉņØĖņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. RatņØś ņóīĻ│©ņŗĀĻ▓Į(sciatic nerve)ņØä ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ļ│┤Ļ│ĀļÉ£ ļ░öņŚÉ ļö░ļź┤ļ®┤ ņåÉņāü ļ░®ļ▓ĢĻ│╝ ņåÉņāü Ēøä ņŗ£ĻĖ░ņŚÉ ļö░ļØ╝ ņøÉņ£äļČĆ ņŗĀĻ▓ĮņØś ņĪ░ņ¦üĒĢÖņĀü ĒŖ╣ņä▒ņŚÉ ņ░©ņØ┤Ļ░Ć ņāØĻĖ░ļŖöļŹ░ ņĢĢļ░Ģ ņåÉņāüņØś Ļ▓ĮņÜ░ ņåÉņāü Ēøä ņŗ£Ļ░äņØ┤ ņ¦Ćļéśļ®┤ņä£ ņ×¼ņāØļÉśļŖö ņŗĀĻ▓ĮņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ćļ¦ī, ņĀłļŗ© ņåÉņāüņØś Ļ▓ĮņÜ░ļŖö ņåÉņāü ņøÉņ£äļČĆņŚÉņä£ ņÖäņĀäĒ׳ Ēć┤ĒÖöļÉ£ ņŗĀĻ▓Įļ¦īņØ┤ Ļ┤Ćņ░░ļÉ£ļŗż[21]. ņÜ░ļ”¼ ņŚ░ĻĄ¼ņŚÉņä£ TLR 2ļŖö ņĢĢļ░ĢĻ│╝ ņĀłļŗ© ņåÉņāü ļ¬©ļæÉņŚÉņä£ 4ņØ╝, 14ņØ╝ņ¦ĖņŚÉ ļ░£ĒśäņØ┤ ņ”ØĻ░ĆĒĢśņ¦Ćļ¦ī ĒŖ╣Ē׳ ņĀłļŗ© ņåÉņāü 14ņØ╝ņ¦ĖņŚÉ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ TLR 2Ļ░Ć ņŗĀĻ▓Į Ēć┤ĒÖö Ļ│╝ņĀĢņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ┤ļ│╝ ņłś ņ׳ļŗż. TLR 2, 4 mRNAļŖö mouseņØś ļćī ĒŚłĒśłņåÉņāü(ischemia) Ēøä ļīĆļćī Ēö╝ņ¦łņØś ļē┤ļ¤░ņŚÉņä£ ļ░£ĒśäņØ┤ ņ”ØĻ░ĆĒĢśļŖöļŹ░, TLR 2, 4 knock-out mouseņŚÉņä£ļŖö ĒŚłĒśłņåÉņāü Ēøä ļéśĒāĆļéśļŖö ņŗĀĻ▓ĮĒĢÖņĀü ņåÉņāüņØ┤ Ļ░ÉņåīĒĢśņŚ¼, ņØ┤ļź╝ ĒåĄĒĢ┤ TLR 2ņÖĆ 4Ļ░Ć ņżæņČöņŗĀĻ▓ĮĻ│äņØś ļē┤ļ¤░ņŚÉņä£ proapoptotic signialing pathwayņŚÉ Ļ┤ĆņŚ¼ĒĢśĻ│Ā ņ׳ņØīņØ┤ Ļ░äņĀæņĀüņ£╝ļĪ£ ņ”Øļ¬ģļÉśņŚłļŹś ļ░ö ņ׳ļŗż. ļ¦Éņ┤łņŗĀĻ▓ĮņØĖ sciatic nerveļź╝ ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļÅä TLR 2 knock-out, TLR 4 mutant miceĻ░Ć ņĢ╝ņāØĒśĢ(wild type)ļ│┤ļŗż ņŗĀĻ▓Į ņåÉņāü Ēøä ļŹö ļåÆņØĆ ņÜ┤ļÅÖ ĻĖ░ļŖźņØś ĒÜīļ│ĄņØä ļ│┤ņśĆĻ│Ā, ĻĘ╝ņ£äļČĆ ņŗĀĻ▓Į ļ¦Éļŗ©ņŚÉņä£ ļŹö ļ¦ÄņØĆ ņŗ╣(nerve terminal sprout)ņØ┤ ņ×ÉļØ╝ļéśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż[22,23].
TLR 9, 13ļŖö ņŗĀĻ▓Į ņåÉņāü 4ņØ╝ņ¦ĖņŚÉļŖö ņĢĢļ░ĢĻĄ░Ļ│╝ ņĀłļŗ©ĻĄ░ ļ¬©ļæÉņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢ┤ņ׳ņ¦Ćļ¦ī, 14ņØ╝ņ¦ĖņŚÉļŖö 4ņØ╝ņ¦ĖņŚÉ ļ╣äĒĢ┤ņä£ļŖö ņ”ØĻ░ĆĒĢśļŖö ņ¢æņāüņØä ļ│┤ņØĖļŗż. ņØĖĻ░äņØś ļŗżļ░£ņä▒ Ļ▓ĮĒÖöņ”Ø(multiple sclerosis)Ļ│╝ ņ£Āņé¼ĒĢ£ ļÅÖļ¼╝ ļ¬©ļŹĖņØĖ ņ×ÉĻĖ░ļ®┤ņŚŁņä▒ ļćīņ▓ÖņłśņŚ╝(experimental autoimmune encephalomyelitis) ņźÉ ļ¬©ļŹĖņŚÉņä£ ņŗØļ¼╝ņä▒ ĒÖöĒĢÖļ¼╝ņ¦łņØĖ ņĀ£ļŗłņŖżĒāĆņØĖ(genistein)ņØä Ēł¼ņŚ¼ĒĢśņśĆņØä ļĢī Ēāłņłśņ┤łĒÖö(demyelination)Ļ░Ć Ļ░ÉņåīĒĢśļŖöļŹ░, ņØ┤ļĢī ņ▓ÖņłśņŗĀĻ▓ĮņŚÉņä£ TLR 3ņÖĆ TLR 9Ļ░Ć ņ”ØĻ░ĆĒĢ£ļŗż. ņĀ£ļŗłņŖżĒāĆņØĖņŚÉ ņØśĒĢ┤ ĒÖ£ņä▒ĒÖöļÉ£ TLR 3, 9Ļ░Ć Ēāłņłśņ┤łĒÖöļź╝ ņ¢ĄņĀ£ĒĢśļŖö ņŚŁĒĢĀņØä ĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ņÜ░ļ”¼ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņÖłļ¤¼ļ│Ćņä▒ņØ┤ ĒÖ£ļ░£ĒĢśĻ▓ī ņ¦äĒ¢ēļÉśņ¢┤ Ēāłņłśņ┤łĒÖöņÖĆ ļČäĒĢ┤ļÉ£ ņłśņ┤łņØś ĒāÉņŗØ ņ×æņÜ®ņØ┤ ņØ╝ņ¢┤ļéśļŖö ņåÉņāü 4ņØ╝ņ¦ĖņŚÉ TLR 9Ļ░Ć ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒ¢łļŗż. ļśÉĒĢ£ ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ TLR 9 knock-out mouseļŖö ņÜ┤ļÅÖ, Ļ░ÉĻ░ü, ņ×Éņ£© ņŗĀĻ▓ĮņØś ņØ┤ņāüņØä ļ│┤ņØ┤ļŖöļŹ░ ņØ┤ļŖö ņŗ£ļāģņŖż(synapse)ņØś ĻĖ░ļŖźĻ│╝ ĒśĢĒā£ņØś ļ│ĆĒÖöņŚÉ ĻĖ░ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ņØ┤ļź╝ ĒåĄĒĢ┤ TLR 9Ļ░Ć ņŗ£ļāģņŖżņØś Ļ░Ćņåīņä▒ņŚÉļÅä Ļ┤ĆņŚ¼ĒĢ£ļŗżĻ│Ā ĒĢśņśĆļŗż[24,25].
ņĢłļ®┤ņŗĀĻ▓ĮņØś ņŗĀĻ▓Į ļČäĒżļŖö ņØĖĻ░ä, ņäżņ╣śļźś ļ░Å ĒåĀļü╝ļ¬®ņØś Ēżņ£ĀļÅÖļ¼╝ņŚÉņä£ ņ£Āņé¼ĒĢśļ®░, ņźÉ ļ░Å ĒåĀļü╝ļŖö ņóģņóģ ņØĖĻ░äņØś ņĢłļ®┤ņŗĀĻ▓Į ĻĖ░ļŖź ļ░Å ņ×¼ņāØņØä ņŚ░ĻĄ¼ĒĢśĻĖ░ ņ£äĒĢ£ ļ¬©ļŹĖļĪ£ ņé¼ņÜ®ļÉśņ¢┤ņÖöļŗż. ĒŖ╣Ē׳ ņĮ¦ņłśņŚ╝ņØś ņÜ┤ļÅÖ(whisker movement of vibrissae muscle)ņØĆ ņĢłļ®┤ņŗĀĻ▓ĮņØś ĒśæļČĆ, ĒĢśņĢģļČäņ¦ĆņŚÉ ņØśĒĢ┤ ņ¦Ćļ░░ļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ņØ┤ņĀäņŚÉ ņŗ£Ē¢ēļÉ£ ņŚ░ĻĄ¼ļōżņŚÉ ļö░ļź┤ļ®┤ ņĢłļ®┤ņŗĀĻ▓ĮņØä ņĀłļŗ©ĒĢ£ ĒøäņŚÉļŖö ļÅÖņĖĪ ņĮ¦ņłśņŚ╝ņØś ņÜ┤ļÅÖņØ┤ ņÖäņĀäĒ׳ ņåīņŗżļÉ£ļŗż. ĒĢśņ¦Ćļ¦ī ņÜ░ļ”¼ņØś ņŚ░ĻĄ¼ņŚÉņä£ ņĢłļ®┤ņŗĀĻ▓Į ņĀłļŗ© 4ņØ╝ņ¦ĖņŚÉļŖö 2.8┬▒0.4, 14ņØ╝ņ¦ĖņŚÉļŖö 2.25┬▒0.5ļĪ£ ņØ╝ļČĆ ņłśņŚ╝ņØś ņøĆņ¦üņ×äņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØ┤ļŖö ņŗżĒŚśņŗż ļé┤ņØś Ļ│ĄĻĖ░ ĒØÉļ”äņØ┤ļéś ņźÉņØś ņøĆņ¦üņ×äņŚÉ ņØśĒĢ£ ņłśļÅÖņĀüņØĖ ņĮ¦ņłśņŚ╝ņØś ņøĆņ¦üņ×äņØä Ļ┤Ćņ░░ņ×ÉĻ░Ć ņśżņØĖĒĢśņśĆņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ļśÉĒĢ£ ņĢłļ®┤ņŗĀĻ▓Į ņåÉņāü Ēøä 4, 14ņØ╝ņØ┤ Ļ▓ĮĻ│╝ĒĢ£ Ēøä ņĖĪņĀĢĒĢśņśĆņ£╝ļ»ĆļĪ£ ņŗĀĻ▓Į ņ×¼ņāØ Ļ│╝ņĀĢņØ┤ ņ¦äĒ¢ēļÉśļ®░ ņŚ░ĒĢ®ņÜ┤ļÅÖ(synkinesis)ņØ┤ ļ░£ņāØĒĢśņŚ¼ ņĮ¦ņłśņŚ╝ņØś ņÜ┤ļÅÖņØ┤ ļéśĒāĆļéĀ ņłś ņ׳Ļ│Ā, ņé╝ņ░©ņŗĀĻ▓ĮņØś ņĢłņÖĆĒĢśļČäņ¦Ć(infraorbinal branch of trigeminal nerve)Ļ░Ć ņ×¼ņāØ Ļ│╝ņĀĢņŚÉņä£ ļ╣äņĢłļ®┤ņŗĀĻ▓Įņä▒ ņĮ¦ņłśņŚ╝ņØś ņÜ┤ļÅÖņŚÉ Ļ┤ĆņŚ¼ĒĢśņśĆņØä Ļ░ĆļŖźņä▒ļÅä ņ׳ļŗż[26,27].
ļ│Ė ņŚ░ĻĄ¼ņŚÉļŖö ļ¬ć Ļ░Ćņ¦Ć ņĀ£ĒĢ£ņĀÉļōżņØ┤ ņ׳ļŗż. ļ©╝ņĀĆ TLRsņØś ļŗ©ļ░▒ņ¦ł ņ¢æņØ┤ ņĢäļŗī mRNAņØś ņ¢æņØä ņĖĪņĀĢĒĢśņŚ¼ Ļ░äņĀæņĀüņ£╝ļĪ£ ļ╣äĻĄÉĒĢśņśĆļŖöļŹ░, mRNAļĪ£ ņĀäņé¼ļÉśņ¢┤ļÅä ļŗ©ļ░▒ņ¦łļĪ£ ĒĢ®ņä▒ļÉśņ¦Ć ņĢŖņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņŗżņĀ£ ĒĢ®ņä▒ļÉśņ¢┤ ņ×æņÜ®ĒĢśļŖö TLRsņØś ņ¢æĻ│╝ļŖö ņ░©ņØ┤Ļ░Ć ņ׳ņØä ņłś ņ׳ļŗż. ļæÉ ļ▓łņ¦ĖļĪ£ ņĀĢņāüĻĄ░, ņĢĢļ░ĢĻĄ░Ļ│╝ ņĀłļŗ©ĻĄ░ Ļ░äņŚÉ ņČĢņéŁ, ņłśņ┤ł, ņŖłļ░śņäĖĒż ļō▒ņØś ĒĢ┤ļČĆĒĢÖņĀü ņ░©ņØ┤ņĀÉņØä ļ╣äĻĄÉĒĢśņ¦Ć ņĢŖņĢśļŗż. ņäĖ ļ▓łņ¦Ė, ņäĖĒż ļŗ©ņ£äņŚÉņä£ņØś ļČäņäØņØ┤ ņĢäļŗłĻĖ░ ļĢīļ¼ĖņŚÉ TLRĻ░Ć ņ¢┤ļ¢ż ņäĖĒżņŚÉņä£ ļ░£ĒśäļÉśņ¢┤ ņ¢┤ļ¢╗Ļ▓ī ņ×æņÜ®ĒĢśļŖö ņ¦ĆļŖö ņĢī ņłś ņŚåņŚłļŗż. ļäż ļ▓łņ¦Ė, ņåÉņāü Ēøä 14ņØ╝Ļ░äņØś ļ│ĆĒÖöļ¦īņØä ļ│┤ņĢśĻ│Ā 3Ļ░£ņøö ņØ┤ņāü ņןĻĖ░Ļ░äņØś ļ│ĆĒÖöļź╝ Ļ┤Ćņ░░ĒĢśņ¦Ć ļ¬╗Ē¢łļŗż.
ĒĢśņ¦Ćļ¦ī ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ņÖĆļŖö ļŗ¼ļ”¼ ņĢłļ®┤ņŗĀĻ▓ĮņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņŗżĒŚśĒĢśņśĆĻ│Ā, ļśÉĒĢ£ 13ņóģņØś ļ¬©ļōĀ TLRsņØś ļ░£ĒśäņØä ņĖĪņĀĢĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗżļŖö Ļ▓āņŚÉ ņØśņØśĻ░Ć ņ׳ņ£╝ļ®░, ĒøäņåŹ ņŚ░ĻĄ¼ņŚÉņä£ western blotņ£╝ļĪ£ ņŗżņĀ£ ĒĢ®ņä▒ļÉ£ TLRsņØś ņ¢æņØä ņĖĪņĀĢĒĢśĻ│Ā 3Ļ░£ņøö ņØ┤ņāüņØś ņןĻĖ░Ļ░ä ņČöņĀü Ļ┤Ćņ░░ņØä ņ¦äĒ¢ē ņżæņŚÉ ņ׳ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ņĢłļ®┤ņŗĀĻ▓Į ņåÉņāü Ēøä ņŗĀĻ▓Įļ¦Éņ┤łļČĆņ£äņŚÉņä£ TLRs mRNA ļ░£ĒśäņØś ļ│ĆĒÖöĻ░Ć ĒÖĢņØĖļÉśņŚłļŗż. ĒŖ╣Ē׳ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņĀłļŗ©ĻĄ░ņŚÉņä£ TLR 2 mRNAĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļ░£ĒśäņØ┤ ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņĢĢļ░ĢĻĄ░Ļ│╝ ņĀłļŗ©ĻĄ░ņŚÉņä£ TLR 9, 13 mRNAņØś ļ░£ĒśäņØ┤ Ļ░Ćņן ņĀüņŚłļŗż. ļö░ļØ╝ņä£ ņŗĀĻ▓ĮņåÉņāü Ēøä TLRs mRNAņØś ļ░£ĒśäņØś ļ│ĆĒÖöĻ░Ć ņĢłļ®┤ņŗĀĻ▓ĮņØś ņåÉņāüĻ│╝ ņ×¼ņāØ Ļ│╝ņĀĢņŚÉ Ļ┤ĆņŚ¼ĒĢśĻ│Ā ņ׳ņØīņØä ņĢī ņłś ņ׳ļŗż.
ACKNOWLEDGMENTSThis study received the excellent research topic of resident award from the Korean society of Otorhinolaryngology-Head and Neck Surgery.
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea government (NRF 2018R1A6A1A03025124). The study protocol was approved by the Kyung Hee University Clinical Research Ethics Committee (KHMC-IACUC 21-005).
NotesAuthor Contribution Conceptualization: Hye Kyu Min, Young Il Kim, Sang Hoon Kim, Seung Geun Yeo. Data curation: Hye Kyu Min, Jae Min Lee. Formal analysis: Jun Yang Jung, Seung Geun Yeo. Funding acquisition: Sang Hoon Kim, Seung Geun Yeo. Investigation: Hye Kyu Min. Methodology: Jun Yang Jung. Project administration: Seung Geun Yeo. Resources: Young Il Kim. Software: Hye Kyu Min. Supervision: Seung Geun Yeo. Validation: Sang Hoon Kim. Visualization: Jae Min Lee. WritingŌĆöoriginal draft: Hye Kyu Min. WritingŌĆöreview & editing: Hye Kyu Min. Fig.┬Ā1.Induction of facial nerve injury. A: Retroauricular incision in the skin and subcutaneous tissue (dotted line). B: Tendon border of the clavotrapezius muscle (arrow). C: Crush injury (arrow). D: Cutting injury (arrow). 
Fig.┬Ā2.Comparison of behavioral test scores in rats. A: Whisker movement of vibrissae muscle in the control, crush, and cutting group on the 4th day after facial nerve injury. B: Whisker movement of vibrissae muscle in the control, crush, and cutting group on the 14th day after facial nerve injury. *p<0.05. 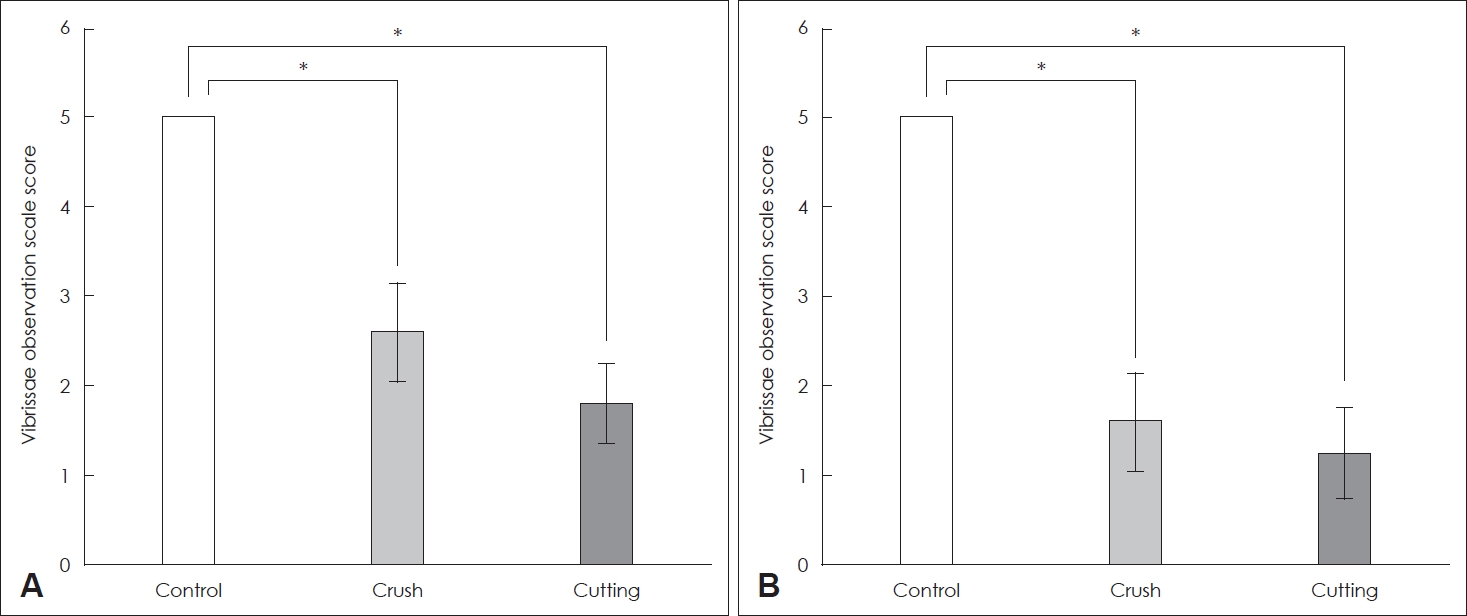
Fig.┬Ā3.Levels of expression of Toll-like receptors in rat facial nerves. A: Expression of TLR 1ŌĆō13 mRNA in the control, crush, and cutting group on the 4th day after facial nerve injury. B: Expression of TLR 1ŌĆō13 mRNA in the control, crush, and cutting group on the 14th day after facial nerve injury. *p<0.05. TLR, Toll-like receptor; mRNA, messenger ribonucleic acid. 
Table┬Ā1.Vibrissae observation scale
Table┬Ā2.Gene specific primers used in this study REFERENCES2. Lee MS, Kim YJ. Pattern-recognition receptor signaling initiated from extracellular, membrane, and cytoplasmic space. Mol Cells 2007;23(1):1-10.
3. Kim MJ, Cho YK. Pattern recognition receptors in immune modulation. Biowave 2006;8(12):1-22.
4. Kawai T, Akira S. The roles of TLRs, RLRs and NLRs in pathogen recognition. Int Immunol 2009;21(4):317-37.
5. Opitz B, Eitel J, Meixenberger K, Suttorp N. Role of toll-like receptors, NOD-like receptors and RIG-I-like receptors in endothelial cells and systemic infections. Thromb Haemost 2009;102(6):1103-9.
6. Okun E, Griffioen KJ, Mattson MP. Toll-like receptor signaling in neural plasticity and disease. Trends Neurosci 2011;34(5):269-81.
7. Frederiksen HR, Haukedal H, Freude K. Cell type specific expression of toll-like receptors in human brains and implications in AlzheimerŌĆÖs disease. Biomed Res Int 2019;2019:7420189.
8. Kilic U, Kilic E, Matter CM, Bassetti CL, Hermann DM. TLR-4 deficiency protects against focal cerebral ischemia and axotomy-induced neurodegeneration. Neurobiol Dis 2008;31(1):33-40.
9. Lee HY, Byun JY, Park MS, Yeo SG. Steroid-antiviral treatment improves the recovery rate in patients with severe BellŌĆÖs palsy. Am J Med 2013;126(4):336-41.
10. Kang HM, Jung SY, Byun JY, Park MS, Yeo SG. Steroid plus antiviral treatment for BellŌĆÖs palsy. J Intern Med 2015;277(5):532-9.
11. de Faria SD, Testa JR, Borin A, Toledo RN. Standardization of techniques used in facial nerve section and facial movement evaluation in rats. Braz J Otorhinolaryngol 2006;72(3):341-7.
12. Hadlock TA, Heaton J, Cheney M, Mackinnon SE. Functional recovery after facial and sciatic nerve crush injury in the rat. Arch Facial Plast Surg 2005;7(1):17-20.
13. Gaudet AD, Popovich PG, Ramer MS. Wallerian degeneration: Gaining perspective on inflammatory events after peripheral nerve injury. J Neuroinflammation 2011;8:110.
15. Jessen KR, Mirsky R. Negative regulation of myelination: Relevance for development, injury, and demyelinating disease. Glia 2008;56(14):1552-65.
16. Stoll G, Jander S, Myers RR. Degeneration and regeneration of the peripheral nervous system: From Augustus WallerŌĆÖs observations to neuroinflammation. J Peripher Nerv Syst 2002;7(1):13-27.
17. Martini R, Fischer S, L├│pez-Vales R, David S. Interactions between Schwann cells and macrophages in injury and inherited demyelinating disease. Glia 2008;56(14):1566-77.
18. Scherer SS, Wrabetz L. Molecular mechanisms of inherited demyelinating neuropathies. Glia 2008;56(14):1578-89.
19. Salzer JL, Brophy PJ, Peles E. Molecular domains of myelinated axons in the peripheral nervous system. Glia 2008;56(14):1532-40.
20. Goethals S, Ydens E, Timmerman V, Janssens S. Toll-like receptor expression in the peripheral nerve. Glia 2010;58(14):1701-9.
21. Stanisz GJ, Midha R, Munro CA, Henkelman RM. MR properties of rat sciatic nerve following trauma. Magn Reson Med 2001;45(3):415-20.
22. Tang SC, Arumugam TV, Xu X, Cheng A, Mughal MR, Jo DG, et al. Pivotal role for neuronal toll-like receptors in ischemic brain injury and functional deficits. Proc Natl Acad Sci U S A 2007;104(34):13798-803.
23. Freria CM, Bernardes D, Almeida GL, Sim├Ąes GF, Barbosa GO, Oliveira AL. Impairment of toll-like receptors 2 and 4 leads to compensatory mechanisms after sciatic nerve axotomy. J Neuroinflammation 2016;13(1):118.
24. Dias AT, de Castro SBR, de Souza Alves CC, Evangelista MG, da Silva LC, Reis DRL, et al. Genistein modulates the expression of toll-like receptors in experimental autoimmune encephalomyelitis. Inflamm Res 2018;67(7):597-608.
25. Patel V, Patel AM, McArdle JJ. Synaptic abnormalities of mice lacking toll-like receptor (TLR)-9. Neuroscience 2016;324:1-10.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 |
 |