 |
 |
AbstractSolitary fibrous tumors (SFTs) are spindle-cell tumors that rarely arise within extrathoracic area. Massive SFTs involving the pterygopalatine fossa are extremely rare and surgical excision represents a multidisciplinary surgical challenge. We present a case of 64-year-old female with a huge mass originating from the pterygopalatine fossa invading the skull base. Distinct microscopic findings and a positive nuclear staining of signal transducer and activator of transcription 6 (STAT-6) pathologically confirmed SFT. The right internal maxillary artery branch was embolized preoperatively and a surgical excision was performed through a combined technique of transpalatal, mid-facial degloving and endoscopic approach. Postoperative radiotherapy successfully removed the remnant tumor adjacent to the carvenous sinus. Follow-up MR images showed no evidence of recurrence for two years. To our knowledge, there has been no previous report of the successful treatment of this vast extent of SFT in the pterygopalatine region via endoscopic-external-combined approach and radiotherapy.
서 론고립성 섬유종(solitary fibrous tumor)은 드물게 발생하는 양성 방추세포 종양으로, 주로 흉막에서 기원하는 것으로 알려져 있다. 1871년 Wagner에 의해 양성 중피종으로 처음 보고되었고, 1931년 Klempere와 Rabin에 의해 고립성 섬유종으로 처음 기술되었다[1]. 주로 발견되는 위치는 흉막이나 그 외에도 폐 실질, 종격동, 복강, 두경부, 사지와 같은 다양한 영역에서 발견된다[1]. 이 중 익구개와(pterygopalatine fossa)에서 발생한 고립성 섬유종은 극히 드물어 현재까지 국내에서 아직 보고된 사례가 없다.
고립성 섬유종의 치료는 외과적 절제를 근간으로 한다. 내시경 술기의 발달과 함께 최근에는 익구개와를 침범한 종물도 내시경적 접근법이 활용되는 추세이나, 병변의 위치에 따라 해부학적 한계로 인해 외부 접근법이 필요할 수 있다. 본 증례에서는 익구개와에서 기원한 고립성 섬유종을 경구개 및 내시경 접근법을 병용하여 수술적으로 절제하고, 수술 후 방사선 치료를 시행하여 성공적으로 치료한 1예를 경험하여 문헌 고찰과 함께 보고하고자 한다.
증 례64세 여성이 내원 3개월 전 발생한 우측 안면 통증을 주소로 내원하였다. 동반 증상으로는 우측 안면 상악동 부위의 동통과 부종, 간헐적인 우측 코막힘이 있었다. 이학적 검사상 우측 볼의 부종과 경계가 명확한 종괴가 촉진되었고, 전산화단층촬영 및 자기공명영상에서 피막에 쌓인 형태의 경계가 명확한 4.6×4.3×4.8 cm 크기의 종물이 확인되었다(Fig. 1A-D). 종물은 우측 익구개와를 기점으로 아래로 우측 협부와 저작공간을 침범하고, 우측 상악동 후벽을 파괴하고 상악동 내부로 돌출되었으며, 위로는 하안와열을 통과하여 우측 해면정맥동을 접하고 있었다. 내시경 하비도 개창술 후 우측 상악동 내 종괴에서 조직 생검을 시행하였고, 면역조직화학염색상 signal transducer and activator of transcription 6 (STAT-6) 양성으로 고립성 섬유종이 진단되었다. 광범위한 해부학적 구조를 침범한 종괴의 치료 방침을 상의하기 위해 방사선종양학과 및 종양내과와 함께 다학제 통합 진료를 시행하였고, 상의 결과 수술 절제 후 보조 방사선 치료를 시행하기로 하였다. 환자와 상의 후 구개폐쇄장치(obturator)를 통해 재건을 시행하기로 결정하였다. 수술 전 시행한 혈관조영술상 우측 내상악동맥이 혈류를 공급하고 있어, 수술 전일 우측 내상악동맥의 분지에 대해 색전술을 시행하였다.
수술은 내시경적 접근법과 경구개 접근법을 병행하여 시행되었다(Fig. 2A and B). 내시경적으로 우측 내측상악골 절제술을 시행하여 종괴의 내측 경계를 확인하였다. 구순하 치은 절개를 우측 협부 점막까지 연장시키고 골막 피판을 들어올린 뒤 구순하 안면중앙 접근법을 병행하여 우측 상악골 전면부를 노출시켰다.
전동톱을 이용하여 경구개에 방정중절개를 가하고 우측 제1소구치까지 포함되도록 치조돌기에 절개를 넣어 우측 부분 상악골 절제술을 시행하였다. 경구개 접근을 통해 경계가 분명한 형태의 종물이 노출되어 우측 협부, 저작 공간, 그리고 상악동에서 박리하였다. 후방의 익구개와 및 측두하와부는 종물이 연조직과 유착되어 있어 분할 절제하였다. 병변은 우측 해면정맥동까지 뻗어 있어 내시경적으로 우측 안와하열까지 최대한 절제를 시행하고 수술을 종료하였다.
병리 결과상 5.5×4.3×3.8 cm 크기의 거대한 고립성 섬유종이 진단되었다. 검체 단면이 회백색의 매끈한 표면을 보였고, 현미경상에서 방추형 세포와 섬유질 영역이 불규칙하게 분포하는 양상이었으며, 특징적인 사슴뿔 모양의 혈관들이 함께 관찰되었다. 유사분열이나 조직 괴사 소견은 보이지 않아 병리적으로 악성 양상을 보이지는 않았으며, STAT-6과 CD99 염색에 양성 소견을 보였다(Fig. 3). 환자는 수술 이후 합병증 없이 회복하였으며, 구개폐쇄장치를 착용하고 경구 식이 가능함을 확인 후 수술 13일차에 퇴원하였다. 잔존 종양에 대해 보조방사선치료를 총 60 Gy 시행하였다. 6개월 뒤 촬영한 자기공명영상에서 우측 안와하열과 해면정맥동 주변의 잔존 종양이 사라졌음을 확인하였으며, 수술 후 2년 후 촬영한 자기공명영상(Fig. 1E and F) 및 외래 진찰(Fig. 2C-E)에서 재발 없이 안정적인 경과를 보였다.
고 찰고립성 섬유종은 전신에 발생 가능한 간엽세포 기원의 종양이다. 1991년 Witkin과 Rosai가 비강, 비인두, 비중격의 고립성 섬유종 6예를 발표하며 두경부에서 처음 확인되었으나, 두경부에서의 발생 비율은 전체 고립성 섬유종 중 약 6%-12%로 드문 편이다[2-4]. 주로 협부 점막, 비강, 인두 영역에서 확인되는 것으로 알려져 있고 익구개와 영역에서는 극히 드물게 확인된다[2].
고립성 섬유종은 전산화단층촬영 영상에서 고밀도-중간밀도의 불균일한 조영증강 양상을 보이며, 압박성 골파괴, 괴사, 혹은 출혈이 보이는 경우 악성종양과의 감별이 필요하다[4,5]. 자기공명영상에서는 T1, T2 강조영상에서 명확한 경계를 가지는 종물로 골격근 대비 동등신호-고신호강도로 나타난다[4,6]. 현미경적으로는 방추형 세포의 ‘패턴 없는’ 배열과 사슴뿔 모양 미세혈관이 발견된다[7]. 다른 간엽성 종양들과 감별을 위해 면역조직화학염색이 필수적이며 대부분의 고립성 섬유종은 CD34, CD99, Bcl-2 염색에서 양성을 보인다(85%-100%) [8]. 반대로 다수의 중피종에서 확인되는 cytokeratin, 간엽성 종양에서 양성을 보이는 S-100, smooth muscle actin 등의 염색에서는 대부분 음성 반응을 나타내 감별 진단에 활용될 수 있다[1,8]. 최근에는 STAT-6 과발현이 확인되는 경우 고립성 섬유종에서 매우 높은 민감도(98%-100%)와 특이도(97.5%)를 보여, 주요 진단 표지자로 활용된다[7-9]. 본 증례에서는 고립성 섬유종의 특징적인 현미경 소견이 확인되고 STAT-6과 CD99에서 양성을 보여 고립성 섬유종이 진단되었다.
고립성 섬유종의 치료는 근본적으로 수술적 절제를 시행하는 것이다. 두경부에서 발생한 고립성 섬유종의 6%-25%가 조직학적으로 악성의 특징을 보이며[2,5,6], 이 경우 국소 재발 및 원격 전이 비율이 높다[3]. 예후에 중요한 요소는 완전 절제가 가능한가 여부로 조직학적 특성과 상관 없이 두경부에서 완전절제를 시행한 이후 재발이 확인된 경우는 극히 드물다[2,5,6]. 주요 해부학적 구조물이 밀집한 두경부의 경우 불완전 절제가 불가피하게 시행될 수 있으며, 이 경우 재발율이 높아지는 것으로 알려져 있다(44%). 수술 후 2-6년이 지난 시점에 재발이 확인된 경우가 많으므로 장기간에 걸친 추적 관찰은 필수적이다[2,3].
보조 치료의 시행 방침은 아직까지 정립되어 있지 않으나, 방사선 치료에는 고립성 섬유종이 상대적으로 잘 반응하는 것으로 알려져 있다. 완전 절제가 불가능한 경우 혹은 조직학적으로 악성이 확인되는 경우 여러 문헌에서 수술 후 보조방사선요법을 시행하였고, 이를 통해 국소 재발율을 줄일 수 있었다[2,5,10]. 항암요법으로는 doxorubicin, gemcitabine, paclitaxel 등의 세포독성제제가 국소 진행성, 재발성 및 전이성 고립성 섬유종에 시행되었으나 반응은 제한적이었다[11]. 최근에는 temozolomide-bevacizumab, sunitinib, sorafenib 등의 새로운 표적치료제들이 치료에 활용되며 고식적인 항암치료보다 나은 결과를 보이는 것으로 보고되어 추가적인 연구가 필요할 것으로 보인다[12,13].
익구개와 고립성 섬유종의 수술 시에는 완전 절제를 위한 넓은 시야를 확보하면서도 술후 합병증을 줄이는 적절한 접근법을 선택하는 것이 중요하다. 익구개와에서 발견되는 주요 종양으로는 비인강 혈관섬유종, 삼차신경초종, 신경섬유종, 림프증식성 질환과 악성종양 등의 병변이 있으며[4,14], 이들의 외과적 절제를 위해 경구개 접근법, 경상악동 접근법, 구순하 안면중앙 접근법, Le-Fort 1형 절골술 등의 비외 접근법이 활용되었다[15]. 최근에는 내시경 접근법이 연조직 파괴를 줄이고 합병증 이환률을 낮추면서도 동등한 치료 성적을 보인다는 사실이 잘 알려져 있으며, 비외 접근법과 병용하는 경우 침습적인 술기를 최소한도로 사용할 수 있다는 장점이 있다[15].
본 증례에서는 익구개와에서 기원하여 여러 두경부 영역을 광범위하게 침범하는 고립성 섬유종이 확인되었다. 내시경만으로는 접근에 한계가 있는 두개저 및 저작공간의 시야 확보를 위해 구순하 안면중앙 접근법, 경구개 접근법을 병용하여 최대한의 절제를 시행하였다. 술전 색전술을 통해 수술 중 출혈을 줄여 효과적인 시야를 확보할 수 있음을 확인하였고, 수술 후 보조 방사선 치료를 시행하는 것이 효과적인 대안 치료로 활용될 수 있음을 보여, 추후 비슷한 증례가 확인되는 경우 치료 방침에 참고할 수 있음을 제시하고자 하였다.
NotesAuthor Contribution Conceptualization: all authors. Data curation: Jang Wook Gwak, Yeong Ju Lee, Myeong Sang Yu. Formal analysis: Jang Wook Gwak, Myeong Sang Yu. Funding acquisition: Jang Wook Gwak. Investigation: Jang Wook Gwak, Sea Eun Yi. Methodology: Jang Wook Gwak, Sea Eun Yi, Yeong Ju Lee. Project administration: Myeong Sang Yu. Resources: Jang Wook Gwak, Sea Eun Yi, Yeong Ju Lee. Supervision: Myeong Sang Yu. Validation: Jang Wook Gwak. Visualization: Jang Wook Gwak, Sea Eun Yi. Writing—original draft: Jang Wook Gwak. Writing—review & editing: Jang Wook Gwak, Yeong Ju Lee. Fig. 1.Pre-operative image study. A and B: Enhanced PNS-CT findings. 4.6×4.3×4.8 cm sized well-defined mass with heterogenous enhancement originating from right pterygopalatine fossa, protruding into right maxillary sinus and masticator space. C and D: PNS-MR image findings. T1WI shows heterogenous iso-hyperintense mass, abutting right lateral pterygoid muscle (arrow) (C). T2WI shows heterogenous iso-hyperintense mass. Note that the mass involves right inferior orbital fissure and carvenous sinus (arrow) through the skull base (D). E and F: Post-operative PNS-MR obtained 2 years after surgery and adjuvant radiotherapy. T1WI represents no evidence of local recurrence in right retroantral and pterygopalatine fossa (arrow) (E). T2WI shows remarkably decreased size and no recurrence of the intracranial lesion (arrow) after radiotherapy (F). PNS, paranasal sinus; T1WI, T1-weighted image; T2WI, T2-weighted images. 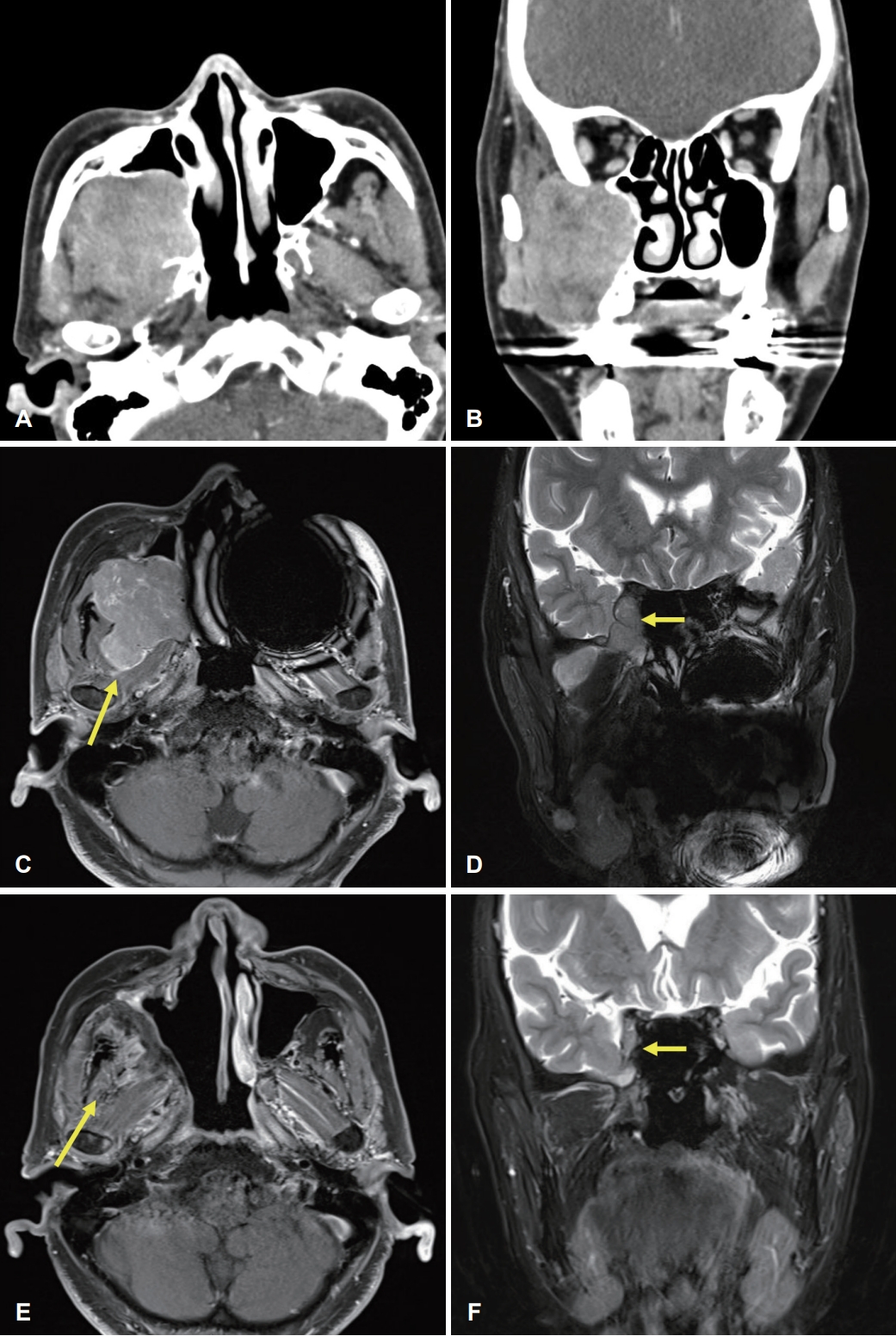
Fig. 2.Intraoperative and follow-up examination view. A and B: Intraoperative findings. Right partial maxillectomy and midfacial degloving maneuver were performed. The known solitary fibrous tumor was removed via transpalatal, mid-facial degloving and endoscopic approach. C-E: Postoperative follow-up exam performed 2 years after surgery. Note that obturator has been applied for palatal reconstruction. Oral cavity and nasal cavity mucosa were completely healed and showed no evidence of recurrence. 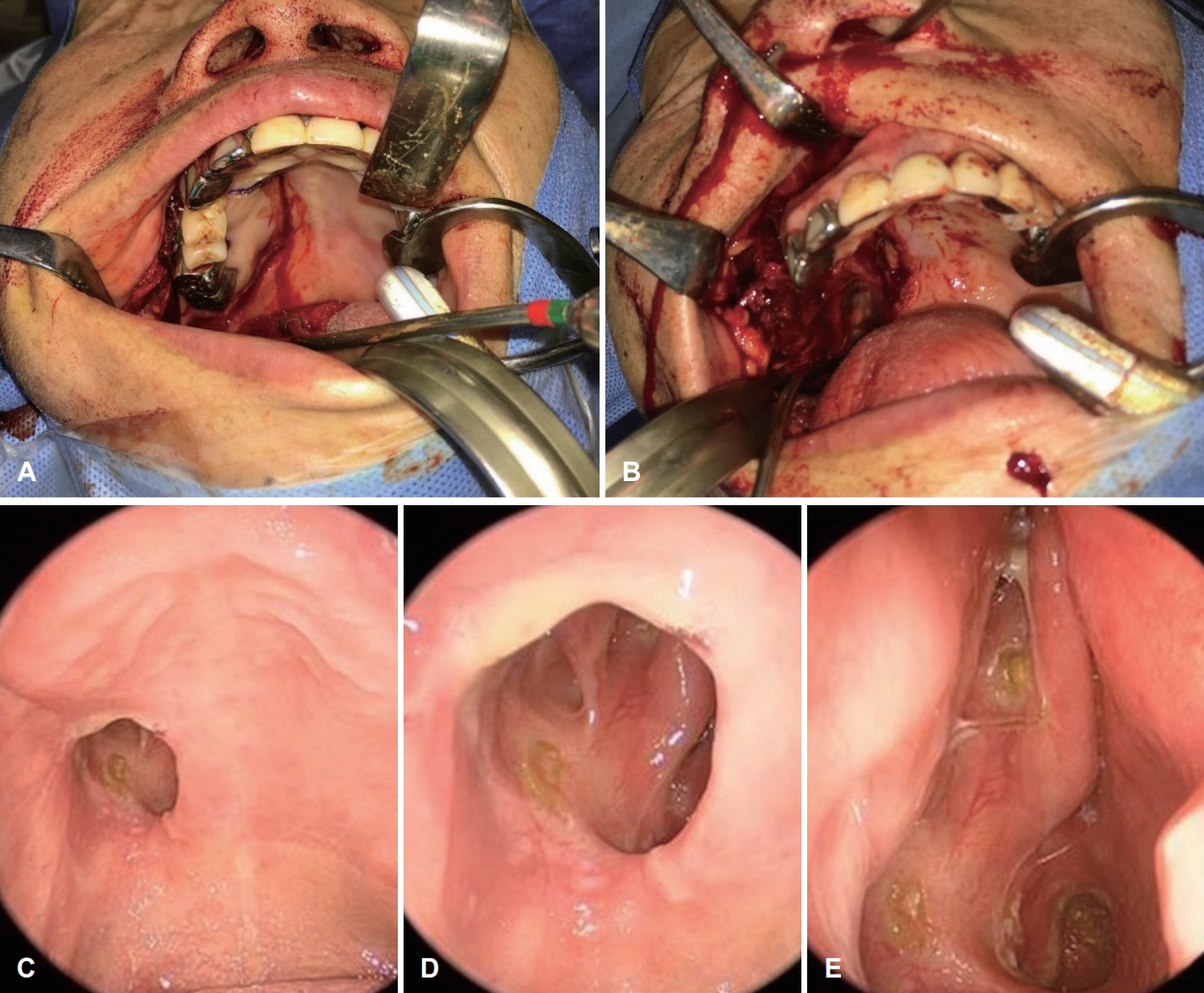
Fig. 3.Histologic findings of solitary fibrous tumor. A: Gross specimen exhibits well-defined firm mass in gray-whitish cross-section. B: Note that a part of right maxillary alveolar process and teeth were resected for transpalatal approach. C: Bundles of spindle cells in ‘pattern-less’ architecture separated by thick collagen tissue in an irregular distribution with mild atypia (H&E, ×200). D: A distinct sharplybranched vasculature so-called ‘staghorn pattern’ (H&E, ×100). Immunohistochemical staining result showing STAT-6 positive tumor cells (E: ×200) and CD99 membranous positive (F: ×400). H&E, hematoxylin and eosin. 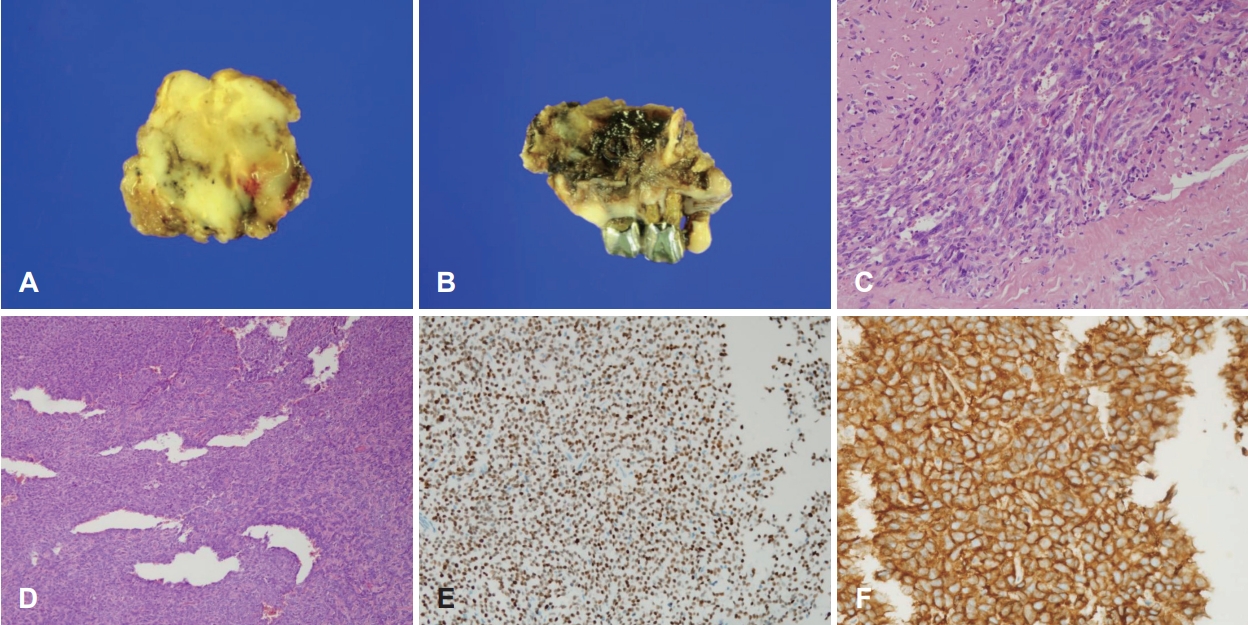
REFERENCES1. Chick JF, Chauhan NR, Madan R. Solitary fibrous tumors of the thorax: Nomenclature, epidemiology, radiologic and pathologic findings, differential diagnoses, and management. AJR Am J Roentgenol 2013;200(3):W238-48.
2. Cox DP, Daniels T, Jordan RC. Solitary fibrous tumor of the head and neck. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2010;110(1):79-84.
3. Gold JS, Antonescu CR, Hajdu C, Ferrone CR, Hussain M, Lewis JJ, et al. Clinicopathologic correlates of solitary fibrous tumors. Cancer 2002;94(4):1057-68.
4. Freiser ME, Castaño JE, Whittington EE, Arnold DJ, Sidani CA. Solitary fibrous tumor of the infratemporal fossa. J Radiol Case Rep 2014;8(12):1-8.
5. Bowe SN, Wakely PE Jr, Ozer E. Head and neck solitary fibrous tumors: Diagnostic and therapeutic challenges. Laryngoscope 2012;122(8):1748-55.
6. Ganly I, Patel SG, Stambuk HE, Coleman M, Ghossein R, Carlson D, et al. Solitary fibrous tumors of the head and neck: A clinicopathologic and radiologic review. Arch Otolaryngol Head Neck Surg 2006;132(5):517-25.
7. Doyle LA, Vivero M, Fletcher CD, Mertens F, Hornick JL. Nuclear expression of STAT6 distinguishes solitary fibrous tumor from histologic mimics. Mod Pathol 2014;27(3):390-5.
8. Geramizadeh B, Marzban M, Churg A. Role of immunohistochemistry in the diagnosis of solitary fibrous tumor, a review. Iran J Pathol 2016;11(3):195-203.
9. Yoshida A, Tsuta K, Ohno M, Yoshida M, Narita Y, Kawai A, et al. STAT6 immunohistochemistry is helpful in the diagnosis of solitary fibrous tumors. Am J Surg Pathol 2014;38(4):552-9.
10. Saito M, Senjo H, Kanaya M, Izumiyama K, Mori A, Tanaka M, et al. Management consideration for patient with a large solitary fibrous tumor occupying the infratemporal fossa: A case report. Mol Clin Oncol 2018;8(4):544-8.
11. Park MS, Ravi V, Conley A, Patel SR, Trent JC, Lev DC, et al. The role of chemotherapy in advanced solitary fibrous tumors: A retrospective analysis. Clin Sarcoma Res 2013;3(1):7.
12. Domont J, Massard C, Lassau N, Armand JP, Le Cesne A, Soria JC. Hemangiopericytoma and antiangiogenic therapy: Clinical benefit of antiangiogenic therapy (sorafenib and sunitinib) in relapsed malignant haemangioperyctoma /solitary fibrous tumour. Invest New Drugs 2010;28(2):199-202.
13. Park MS, Patel SR, Ludwig JA, Trent JC, Conrad CA, Lazar AJ, et al. Activity of temozolomide and bevacizumab in the treatment of locally advanced, recurrent, and metastatic hemangiopericytoma and malignant solitary fibrous tumor. Cancer 2011;117(21):4939-47.
14. Isolan GR, Bernardi JM, Telles JPM, Rabelo NN, Figueiredo EG. Pterygopalatine fossa: Microsurgical anatomy and its relevance for skull base surgery. Arq Bras Neurocir 2021;40(1):51-8.
15. An YH, Kim SW, Jung EJ, Shim WS, Won TB, Kim YM, et al. Treatment of nasopharyngeal angiofibroma: Results according to the surgical modalities. Korean J Otolaryngol-Head Neck Surg 2005;48(12):1473-7.
|
|
||||||||||||||||||||||||||||||||||||||||||

 |
 |