 |
 |
AbstractCis-diamminedichloroplatinum(II) (cisplatin), platinum compound, is an anti-cancer agent currently used for the treatment of a number of human solid cancers. It irreversibly reacts with DNA to form an interconnection between guanine-group helices, resulting in cell death. Furthermore, it is also associated with numerous adverse effects such as nephrotoxicity, neurotoxicity, and ototoxicity. Hearing loss due to cisplatin ototoxicity is usually permanent and bilateral. Many studies have been conducted on the ototoxicity of cisplatin, however, its pathology and treatment have not been fully elucidated. Studies have reported that cisplatin inhibits the action of adenylate cyclase in the stria vascularis, and hearing loss occurs due to a decrease in the receptor current of the outer hair cells. In addition, it has been reported that morphological changes in the inner ear include changes in outer hair cells and abnormal findings in the supporting cells of the organ of Corti and ReissnerŌĆÖs membrane. Oxidative stress is known to be the main cause of ototoxicity. In addition, it has recently been suggested that inflammation may trigger inner ear cell death through autophagy, necrosis, and endogenous apoptosis. In this review, we intend to provide a basis for the prevention strategy of cisplatin-induced ototoxicity by revealing its molecular targets and intracellular pathways.
ņä£ ļĪĀņŗ£ņŖżĒöīļØ╝Ēŗ┤(cisplatin)ņØĆ ņóģņ¢æņäĖĒżņØś ņ”ØņŗØņØä ņ¢ĄņĀ£ĒĢśļŖö ĒĢŁņĢöņĀ£ļĪ£ņä£ ļæÉĻ▓ĮļČĆ ņĢģņä▒ņóģņ¢æ ļ░Å ņŚ¼ļ¤¼ Ļ│ĀĒśĢņĢö(ļé£ņåīņĢö, Ļ│ĀĒÖśņĢö, ļ░®Ļ┤æņĢö, ĒÅÉņĢö ļō▒)ņØś ņ╣śļŻīņŚÉ ņØ┤ņÜ®ļÉśĻ│Ā ņ׳ļŗż[1,2]. ņØ┤ļŖö DNAņŚÉ ļ╣äĻ░ĆņŚŁņĀüņ£╝ļĪ£ ļ░śņØæĒĢśņŚ¼ ĻĄ¼ņĢäļŗīĻĖ░ņØś ļéśņäĀ Ļ░Ćļŗźļōż ņé¼ņØ┤ņŚÉņä£ņØś ņāüĒśĖ ņŚ░Ļ▓░ņØä ĒåĄĒĢ┤ ņäĖĒż ĒīīĻ┤┤ļź╝ ņ£Āļ░£ĒĢśļŖö ņĢĮļ¼╝ļĪ£ņä£ ĒĢŁņĢö ĒÜ©Ļ│╝ ņÖĖņŚÉ Ļ░Ćļ│ŹĻ▓īļŖö ĻĄ¼ņŚŁ, ĻĄ¼ĒåĀ ļō▒ņØś ļČĆņ×æņÜ® ņØ╝ņ£╝Ēéżļ®░, ņŗĀļÅģņä▒, ņŗĀĻ▓ĮļÅģņä▒ ļ░Å ņØ┤ļÅģņä▒ ļō▒ņØś ņśüĻĄ¼ņĀüņØĖ ļČĆņ×æņÜ® ļśÉĒĢ£ ņ£Āļ░£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[1,2]. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņŚÉ ņØśĒĢ£ ļČĆņ×æņÜ®ņØĆ ĒŖ╣Ē׳ ņåīņĢäņŚÉņä£ ņŗ¼ĒĢśļ®░, Ēł¼ņŚ¼ ļ░øļŖö ņåīņĢäņØś 60% ņØ┤ņāüņØ┤ ņŗĀĻĖ░ļŖźņןņĢĀļź╝ Ļ▓ĮĒŚśĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, ņĢĮ 60% ņØ┤ņāüņØś ņåīņĢäņŚÉņä£ ņśüĻĄ¼ņĀüņØĖ ņ▓ŁļĀźņĀĆĒĢśĻ░Ć ņ£Āļ░£ļÉ£ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[3-5]. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņŚÉ ņØśĒĢ£ ļé£ņ▓ŁņØĆ ņ¢æņĖĪņä▒ņ£╝ļĪ£ ņ¦äĒ¢ēĒĢśļŖö ļ╣äĻ░ĆņŚŁņĀü Ļ░ÉĻ░üņŗĀĻ▓Įņä▒ ļé£ņ▓ŁņØś ĒśĢĒā£ļĪ£, ņĀä ņŚ░ļĀ╣ļīĆņŚÉņä£ņØś ņ£Āļ│æļźĀņØĆ ļ¼ĖĒŚīņŚÉ ļö░ļØ╝ ļŗżņ¢æĒĢśņŚ¼ 11%-97% ņĀĢļÅäņØ┤ļ®░, ĒÅēĻĘĀ 62%ņØś ļ░£ņāØļ╣łļÅäļź╝ ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[6,7]. ņØ┤ļŖö Ēł¼ņŚ¼ ļ░®ļ▓Ģ, Ēł¼ņŚ¼ ņÜ®ļ¤ē, ņ▓┤ļé┤ ļłäņĀü ņÜ®ļ¤ē, ĒÖśņ×ÉņØś ļéśņØ┤, ļŗżļźĖ ņØ┤ļÅģņä▒ ņĢĮļ¼╝ņØś ļ│æņÜ®Ēł¼ņŚ¼ ļ░Å ļæÉĻ▓ĮļČĆ ļ░®ņé¼ņäĀ ņ╣śļŻī ļō▒Ļ│╝ ļ░ĆņĀæĒĢ£ Ļ┤ĆļĀ©ņØ┤ ņ׳ņ£╝ļ®░, Ļ│ĀņØīņŚŁļīĆļČĆĒä░ ņ¦äĒ¢ēĒĢśļŖö ļé£ņ▓Ł ņÖĖņŚÉļÅä ņĢĮ 2%-36%ņŚÉņä£ ņØ┤ļ¬ģņØä ļÅÖļ░śĒĢśĻĖ░ļÅä ĒĢ£ļŗż[8]. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ĒśłĻ┤ĆņĪ░ņŚÉņä£ adenylate cyclase ņ×æņÜ®ņØä ņ¢ĄņĀ£ĒĢśņŚ¼, ņ£Āļ¬©ņäĖĒżņØś ņłśņÜ®ņ▓┤ ņĀäļźś(receptor current)ļź╝ Ļ░Éņåīņŗ£ņ╝£ ļé£ņ▓ŁņØä ņ£Āļ░£ĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, ņÖĖņ£Āļ¬©ņäĖĒż ļ░Å ņ¦Ćņ¦ĆņäĖĒż ļō▒ņØś ĒśĢĒā£ĒĢÖņĀü ņØ┤ņāü ļśÉĒĢ£ ņ£Āļ░£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[9]. ņØ┤ņ▓śļ¤╝ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØä ņÖĆņÜ░ņØś ņ¦üņĀæņĀü ņåÉņāüņ£╝ļĪ£ ņäżļ¬ģĒĢśļŖö Ļ▓āņØ┤ ņØ╝ļ░śņĀüņØ┤ļéś, ĒĢŁņĢöņĀ£ļĪ£ņä£ņØś ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś Ēæ£ņĀüņØĆ ņ”ØņŗØĒĢśļŖö ņóģņ¢æ ņäĖĒżņØś ĒĢĄ DNAņØĖļŹ░ ļ░śĒĢ┤, ņ”ØņŗØĒĢśņ¦Ć ņĢŖļŖö ņÖĆņÜ░ņäĖĒżĻ░Ć ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś ņśüĒ¢źņØä ļ░øļŖö ĻĖ░ņĀäņØĆ ņĢäņ¦ü ļ¬ģĒÖĢĒ׳ ņØ┤ĒĢ┤ļÉśņ¦Ć ņĢŖļŖöļŗż. ļö░ļØ╝ņä£ Ēśäņ×¼Ļ╣īņ¦Ć ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØś ļ¬ģĒÖĢĒĢ£ ļ░£ņāØ ļČĆņ£äņÖĆ ĻĖ░ņĀäņŚÉ ļīĆĒĢ┤ņä£ļŖö ļģ╝ļ×ĆņØ┤ ņ׳ņ£╝ļ®░, ņØ┤ļź╝ ņśłļ░®ĒĢĀ ņłś ņ׳ļŖö FDA ņŖ╣ņØĖ ņĢĮļ¼╝ļÅä ņŚåļŖö ņāüĒā£ņØ┤ļŗż[9].
ļ│Ė ņóģņäżņŚÉņä£ļŖö Ēśäņ×¼Ļ╣īņ¦Ć ņĢīļĀżņ¦ä ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ĒĢŁņĢöņĀ£ņØś ņØ┤ļÅģņä▒ ĻĖ░ņĀäņØä ņĀĢļ”¼ĒĢśņŚ¼, ņØ┤ļÅģņä▒ņ£╝ļĪ£ļČĆĒä░ ņÖĆņÜ░ņ£Āļ¬©ņäĖĒżļź╝ ļ│┤ĒśĖĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼ņØś ņ┤łņäØņ£╝ļĪ£ņä£ ļČäņ×É Ēæ£ņĀüņØś ņØ┤ĒĢ┤ļź╝ ļÅĢĻ│Āņ×É ĒĢ£ļŗż.
ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś ĒĢŁņĢöņ×æņÜ® ĻĖ░ņĀäņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ 1844ļģä ņØ┤Ēāłļ”¼ņĢä ĒÖöĒĢÖņ×ÉņØĖ Michele PeyroneņŚÉ ņØśĒĢ┤ ņ▓śņØī ĒĢ®ņä▒ļÉśņŚłņ£╝ļ®░, 1966ļģä ļ»Ėņŗ£Ļ▒┤ ļīĆĒĢÖņøÉņØś ņāØļ¼╝ĒĢÖņ×ÉņØĖ Barnett RosenbergĻ░Ć ņ¦äĒĢĄņäĖĒż ļČäņŚ┤ņŚÉ ļīĆĒĢ£ ņ×ÉĻĖ░ņןņØś ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśļŹś ņżæ ņÜ░ņŚ░Ē׳ ņ×ÉĻĖ░ņןņŚÉņä£ ņ▓ĀņØś ļ░░ņŚ┤ņØ┤ ņäĖĒżļČäņŚ┤ņŚÉņä£ ļ│╝ ņłś ņ׳ļŖö ņ£Āņé¼ļČäņŚ┤ ļ░®ņČöņØś ļ░░ņŚ┤Ļ│╝ ņ£Āņé¼ĒĢśļŗżļŖö Ļ▓āņØä ļ░£Ļ▓¼ĒĢśļ®┤ņä£ ņØ┤ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņŗ£ņ×æļÉśņŚłļŗż[10,11]. ĻĘĖļŖö ĒøäņåŹ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ņÜ®ĒĢ┤ļÉ£ ļ░▒ĻĖłņØ┤ ņĢöļ¬©ļŖä ļ░Å ņŚ╝ĒÖöļ¼╝ņØ┤ņś©Ļ│╝ ļ░śņØæĒĢśņŚ¼ ņäĖĒż ļČäņŚ┤ņØä ņ¢ĄņĀ£ĒĢśļŖö ņŚŁĒĢĀņØä ĒĢ£ļŗżļŖö Ļ▓āņØä ļ░£Ļ▓¼ĒĢśņśĆļŖöļŹ░, ņØ┤ ĒÖöĒĢ®ļ¼╝ņØ┤ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØ┤ļŗż[12,13]. ņØ┤Ēøä ļ░▒Ēśłļ│æĻ│╝ ņ£Īņóģ(sarcoma) ļ¦łņÜ░ņŖżļ¬©ļŹĖ ņŗżĒŚśņØä ĒåĄĒĢ┤ ņØ┤ ĒÖöĒĢ®ļ¼╝ņØś ĒĢŁ ņóģņ¢æ ĒÖ£ņä▒ņØä ĒÖĢņØĖĒĢ©ņ£╝ļĪ£ņŹ©, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ Ēśäņ×¼ ļæÉĻ▓ĮļČĆņĢö, ņŗØļÅäņĢö, ĒÅÉņĢö, Ļ│ĀĒÖśņĢö, ļé£ņåīņĢö, ņ×ÉĻČüĻ▓ĮļČĆņĢö ļō▒ ļŗżņ¢æĒĢ£ Ļ│ĀĒśĢ ņóģņ¢æņØś ņ╣śļŻīņŚÉ ļäÉļ”¼ ņØ┤ņÜ®ļÉśĻ│Ā ņ׳ļŗż[13-15].
ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ļŗżņ¢æĒĢ£ ĻĖ░ņĀäņ£╝ļĪ£ ņĢöņäĖĒżļź╝ ņĀ£Ļ▒░ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░, ņóģņ¢æņäĖĒż DNAņÖĆņØś Ļ▓░ĒĢ® ļ░Å ļČĆĻ░Ćļ¼╝ ĒśĢņä▒(adduct formation)ņØ┤ ņóģņ¢æ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś ņŻ╝ņÜö Ēæ£ņĀüņØĖ Ļ▓āņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦äļŗż. ņŗ£ņŖżĒöīļØ╝Ēŗ┤Ļ│╝ ņóģņ¢æņäĖĒż DNAņØś Ļ▓░ĒĢ®ņØĆ ņĀäņé¼ņÖĆ DNA ļ│ĄņĀ£ļź╝ ņ¢ĄņĀ£ĒĢśĻ│Ā, ņŗ£ņŖżĒöīļØ╝Ēŗ┤-DNA ļČĆĻ░Ćļ¼╝ņØś ļ│ĄĻĄ¼Ļ░Ć ņĀ£ļīĆļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņ£╝ļ®┤, ņĢöņäĖĒżņØś ņäĖĒżņ×Éļ®Ėņé¼(apoptosis)Ļ░Ć ņØ╝ņ¢┤ļéśļ®┤ņä£ ņäĖĒżĻ░Ć ņé¼ļ®ĖĒĢ£ļŗż[16-18]. ļśÉĒĢ£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ņóģņ¢æņäĖĒżņØś DNAņŚÉ Ļ▓░ĒĢ®ĒĢśņŚ¼ Ļ░ĢļĀźĒĢ£ ņé░ĒÖö ņŖżĒŖĖļĀłņŖż ļ░śņØæņØä ņāØņä▒ĒĢśļ®░, Ļ┤┤ņé¼(necoptosis) ļ░Å ferroptosisļź╝ ĒåĄĒĢ┤ ņČöĻ░ĆņĀüņØĖ ņäĖĒżļÅģņä▒ ĻĖ░ņĀäņ£╝ļĪ£ ņäĖĒżņé¼ļ®ĖņØä ņØ╝ņ£╝ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ļŗż[19-22].
ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņĀäņŗĀĒł¼ņŚ¼ļÉ£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ņ┤łĻĖ░ņŚÉļŖö ņÖĆņÜ░ņØś Ļ│ĀņŻ╝ĒīīņśüņŚŁņŚÉņä£ ņÖĖņ£Āļ¬©ņäĖĒżņØś ņé¼ļ®ĖņØä ņØ╝ņ£╝Ēéżņ¦Ćļ¦ī, ņ¦äĒ¢ēļÉśļ®┤ ņĀĆņŻ╝ĒīīņśüņŚŁņ£╝ļĪ£ ņäĖĒż ņé¼ļ®ĖņØ┤ ņ¦äĒ¢ēļÉ£ļŗż[8,23,24]. ļö░ļØ╝ņä£ ņ¦ĆņåŹņĀüņØĖ ņØ┤ļÅģņåīņØś ņ▓┤ļé┤ ļłäņĀüļ¤ēņØś ņ”ØĻ░ĆļŖö ņĀäņŻ╝Ēīīņłś ņśüņŚŁņ£╝ļĪ£ņØś ņśüĻĄ¼ņĀüņØĖ ņ▓ŁļĀź ņåÉņŗżņØś ņ£äĒŚśņä▒ ņ”ØĻ░Ćļź╝ ņØśļ»ĖĒĢ£ļŗż[23,25]. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ņŻ╝ļĪ£ ņ£Āļ¬©ņäĖĒżņŚÉ ņ¦üņĀæņĀüņØĖ ņåÉņāüņØä ļ»Ėņ╣śļŖö Ļ▓āņ£╝ļĪ£ ņל ņĢīļĀżņĀĖņ׳ņ£╝ļéś, ņ£Āļ¬©ņäĖĒż ņÖĖņŚÉļÅä ņ¦Ćņ¦ĆņäĖĒż, ļéśņäĀņŗĀĻ▓ĮņĀł ņäĖĒżņŚÉļÅä ņśüĒ¢źņØä ņŻ╝ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[26-28]. ņØ┤ļÅģņä▒ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ņØś ļīĆļČĆļČäņØ┤ ņĀĢņāü ņÖĆņÜ░ļź╝ ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼ļĪ£ ņ¦äĒ¢ēļÉśĻĖ░ ļĢīļ¼ĖņŚÉ, ņØ┤ļÅģņä▒ņØś ņØ╝ņ░© ļČĆņ£äņŚÉ ļīĆĒĢ£ Ļ▓░ņĀĢņØĆ ņēĮņ¦Ć ņĢŖļŗż. ņØ╝ļČĆ ņŚ░ĻĄ¼ņŚÉņä£ņØś ļ│ĄĒĢ®ĒÖ£ļÅÖņĀäņ£ä(compound action potential, CAP)ņÖĆ ņ▓Łņä▒ļćīĻ░äļ░śņØæ(auditory brainstem response, ABR) ņŚŁņ╣ś ņ”ØĻ░Ć Ļ▓░Ļ│╝ļŖö ļéśņäĀ ņŗĀĻ▓ĮņĀłņØś ņåÉņāüņØä ļ░śņśüĒĢśļŖöļŹ░, ņØ┤ļŖö ņÖĖņ£Āļ¬©ņäĖĒżņÖĆ ļÅÖņŗ£ņŚÉ ņĀ£ 1ĒśĢ ļéśņä▒ ņŗĀĻ▓ĮņĀłņØś ņłśņ┤ł ņåÉņŗżĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż[29]. ļśÉĒĢ£ ABR ņŚŁņ╣ś ņ”ØĻ░Ć Ļ▓░Ļ│╝ļŖö ļé┤ļ”╝ĒöäņØś Ca2+ ļ░Å K+ ļåŹļÅäņØś Ļ░ÉņåīļĪ£ ņØĖĒĢ£ Ļ▓░Ļ│╝ņØ╝ ņłś ņ׳ļŖöļŹ░, ņØ┤ļŖö ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņŚÉ ņØśĒĢ£ ņÖĆņÜ░ ņĖĪļ▓ĮņØś Na+/K+-ATPase ĒÖ£ņä▒ Ļ░ÉņåīņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ņØä ņłś ņ׳ļŗż[30]. Ēśäņ×¼Ļ╣īņ¦Ć ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņŚÉ ļīĆĒĢ£ ļČäņ×ÉņĀü ņØ┤ĒĢ┤ļź╝ ļÅĢĻĖ░ ņ£äĒĢ£ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ļōżņØ┤ ņ¦äĒ¢ēļÉśņŚłņ£╝ļéś, ņĢäņ¦üĻ╣īņ¦Ć ļ¬ģĒÖĢĒĢ£ ĻĖ░ņĀä ĒÖĢņØĖņŚÉļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż.
ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś ņäŁņĘ© ļ░Å ĒØĪņłśņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ĒśłĻ┤ĆņĪ░(stria vascularis)ļź╝ ĒåĄĒĢ┤ ņÜ░ņäĀņĀüņ£╝ļĪ£ ņÖĆņÜ░ļĪ£ ļōżņ¢┤Ļ░ä Ēøä ļé┤ļ”╝ĒöäņŚÉņä£ ņ£Āļ¬©ņäĖĒżļĪ£ ļōżņ¢┤Ļ░äļŗżĻ│Ā ĒĢ£ļŗż[31-33]. ĻĄ¼ļ”¼ ņ£Āņé¼ ņłśņåĪņ▓┤-1 (copper-like transport-1, CTR1) ļ░Å ņ£ĀĻĖ░ ņ¢æņØ┤ņś© ņłśņåĪņ▓┤-2 (organic cation transporter 2, OCT2)ļŖö ĒśłĻ┤ĆņĪ░ņØś ņäĖĒżņŚÉņä£ ļ░£ĒśäļÉśņ¦Ćļ¦ī ļéśņäĀ ņØĖļīĆņŚÉņä£ļŖö ļ░£ĒśäļÉśņ¦Ć ņĢŖļŖö ņĀÉņ£╝ļĪ£ ļ│┤ņĢä, ņØ┤ļōżņØ┤ ĒśłņĢĪ-ļ»ĖļĪ£ ņןļ▓Į(blood labyrinth barrier, BLB)ņØä Ļ░ĆļĪ£ņ¦łļ¤¼ ļé┤ļ”╝Ēöä ļé┤ļĪ£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØä ņłśņåĪĒĢśļŖö ņ×Āņ×¼ņĀüņØĖ ņłśņåĪ ļ®öņ╗żļŗłņ”śņØ╝ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[34-36].
ņØ╝ļ░śņĀüņ£╝ļĪ£ ņĢĮļ¼╝ņŚÉ ņØśĒĢ£ ņśüĻĄ¼ņĀü ņØ┤ļÅģņä▒ņØ┤ ņØ╝ņ¢┤ļéśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņØ┤ļÅģņåīĻ░Ć ņ£Āļ¬©ņäĖĒżņŚÉ ļōżņ¢┤Ļ░ĆļŖö Ļ│╝ņĀĢņØ┤ ĒĢäņÜöĒĢ£ļŹ░, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØ┤ ņ£Āļ¬©ņäĖĒżļĪ£ ļōżņ¢┤Ļ░ĆļŖö ņĀĢĒÖĢĒĢ£ ĻĖ░ņĀäņØĆ Ēśäņ×¼Ļ╣īņ¦ĆļŖö ņĢīĻĖ░ ņ¢┤ļĀżņÜ┤ ņāüĒā£ņØ┤ļéś, Hall ļō▒ņØś ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņłśļÅÖņĀüņØĖ ĒÖĢņé░ Ļ│╝ņĀĢņØä ĒåĄĒĢ┤ņä£ļÅä ļ░░ņ¢æļÉ£ ņ£Āļ¬© ņäĖĒżļĪ£ ļōżņ¢┤Ļ░ł ņłś ņ׳ņØīņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[37,38]. ļśÉĒĢ£ ņ£Āļ¬©ņäĖĒżņØś stereocilia ļüØļČĆļČäņŚÉļŖö ļ╣äņäĀĒāØņĀü ņ¢æņØ┤ņś©ņ▒äļäÉņØĖ ļ¦ēĒł¼Ļ│╝ ņ▒äļäÉ ņ£Āņé¼ ļŗ©ļ░▒ņ¦ł(transmembrane channel-like protein-1, TMC1)ņØ┤ ņ׳ņ¢┤ ļ¼╝ņ¦łņØś ĻĖ░Ļ│äņĀü Ļ░£ĒÅÉņŚÉ ņ×æņÜ®ĒĢśĻ▓ī ļÉśļŖöļŹ░, ņĀ£ļĖīļØ╝Ēö╝ņē¼ļź╝ ņØ┤ņÜ®ĒĢ£ Ļ│╝Ļ▒░ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĻĖ░ļŖźņĀü TMC1 ņ▒äļäÉņØä Ļ░Ćņ¦ä ņ£Āļ¬©ņäĖĒżņØś Ļ▓ĮņÜ░ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņŚÉ Ļ░Ćņן ņĘ©ņĢĮĒĢ©ņØä ĒÖĢņØĖĒĢ©ņ£╝ļĪ£ņŹ©, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØä ņ£Āļ¬©ņäĖĒżļĪ£ ņłśņåĪļÉśļŖö Ļ│╝ņĀĢņŚÉ TMC1 ņ▒äļäÉņØ┤ Ļ┤ĆņŚ¼ĒĢĀ Ļ▓āņ£╝ļĪ£ ņČöņĖĪļÉ£ļŗż[39-41]. ĒśłĻ┤ĆņĪ░ņäĖĒżņŚÉņä£ ļ░£ĒśäļÉśļŖö CTR1, OCT2 ņłśņåĪņ▓┤ļŖö ņÖĆņÜ░ ņ£Āļ¬©ņäĖĒżņŚÉņä£ļÅä ļ░£ĒśäņØä ĒÖĢņØĖĒĢ©ņ£╝ļĪ£ņŹ©, ņØ┤ļōżņØ┤ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś ņ£Āļ¬©ņäĖĒżļĪ£ņØś ĒØĪņłśļÅä ļÅĢļŖö Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[40,41]. OCT ņ░©ļŗ©ņĀ£ņØĖ ņŗ£ļ®öĒŗ░ļöśņØä ņĀäņŗĀĒł¼ņŚ¼ĒĢśĻ▒░ļéś OCTņØś ņ£ĀņĀäņĀü ĒāłļØĮņØä ņ£Āļ░£ĒĢśļŖö ĒÖ®ņé░ĻĄ¼ļ”¼ļź╝ ĻĄŁņåī Ēł¼ņŚ¼ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØś ņÖäĒÖö ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢśņŚ¼ OCTĻ░Ć ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś ņ£Āļ¬©ņäĖĒżļĪ£ņØś ņłśņåĪņŚÉ Ļ┤ĆņŚ¼ĒĢ©ņØä ļÆĘļ░øņ╣©ĒĢśļŖö ĻĘ╝Ļ▒░ļĪ£ ņĀ£ņŗ£ļÉśņŚłņ£╝ļéś, ņĀ£ļĖīļØ╝Ēö╝ņē¼ ņŚ░ĻĄ¼ ļō▒ņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ ņłśņåĪņ▓┤ņØś ļ░£ĒśäņØ┤ ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢä, Ēśäņ×¼Ļ╣īņ¦ĆļŖö TMC1 ņ▒äļäÉņØ┤ ņŻ╝ļÉ£ ņłśņåĪ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[34,35]. ĒØĪņłśļÉ£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ņŚ╝ĒÖöļ¼╝ ņżæ ĒĢśļéś ļśÉļŖö ļæś ļ¬©ļæÉĻ░Ć ļ¼╝ ļČäņ×ÉņŚÉ ņØśĒĢ┤ ļīĆņ▓┤ļÉśņ¢┤ ļé«ņØĆ ļ¦ēĒł¼Ļ│╝ņä▒ņØä Ļ░¢ļŖö ņĢäņ┐ĀņĢäļ│ĄĒĢ®ņ▓┤ļź╝ ņāØņä▒ĒĢśļŖö ņłśĒÖö Ļ│╝ņĀĢņØä Ļ▒░ņ╣£ļŗż[42]. ļśÉĒĢ£ ņ£Āļ¬©ņäĖĒżļĪ£ ļōżņ¢┤Ļ░ä ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ņĄ£ņåī 12-18Ļ░£ņøö ļÅÖņĢł ņ£Āņ¦ĆļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż(Fig. 1) [31].
ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņŚÉ ņØśĒĢ£ ņØ┤ļÅģņä▒ņØś ļČäņ×É ĻĖ░ņĀäņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ņ£Āļ¬©ņäĖĒżļĪ£ ļōżņ¢┤Ļ░Ćļ®┤ ņäĖĒżņé¼ļ®ĖņØś ņŚ¼ļ¤¼ ļ®öņ╗żļŗłņ”śņØä ņ£Āļ░£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ļŗż[43,44]. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ņØ╝ņ░©ņĀüņ£╝ļĪ£ ņäĖĒżļČäņŚ┤ Ļ│╝ņĀĢņŚÉņä£ DNAņÖĆ Ļ▓░ĒĢ®ĒĢśņŚ¼ ņäĖĒżņ×Éļ®Ėņé¼ļź╝ ņ£Āļ░£ĒĢ£ļŗż. ĻĘĖļ¤¼ļéś ņäĖĒżļČäņŚ┤ņØä ĒĢśņ¦Ć ņĢŖļŖö Ēżņ£ĀļÅÖļ¼╝ņØś ņ£Āļ¬©ņäĖĒżņŚÉļÅä ņäĖĒż ļé┤ Ļ▓ĮļĪ£ņÖĆ ļŗ©ļ░▒ Ļ▓░ĒĢ®ņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¢┤ ņäĖĒż ņĪ░ņĀłņØä ņåÉņāüņŗ£ĒéżĻ│Ā ļŗ©ļ░▒ Ļ▓░ĒĢ®ņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¢┤ ņäĖĒżņé¼ļ®ĖņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗż(Fig. 2) [44-46].
ņŚ╝ņ”Ø(Inflammation)ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØĆ ņŚ╝ņ”Øļ░śņØæņØś ņ×ÉĻĘ╣Ļ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖöļŹ░, ņäĖĒżņÖĖ ņŗĀĒśĖņĪ░ņĀł ĒéżļéśņĢäņĀ£(extracellular signal-regulated kinases, ERK)ļź╝ ĒÖ£ņä▒ĒÖö ĒĢ©ņ£╝ļĪ£ņŹ©, ņóģņ¢æĻ┤┤ņé¼ņØĖņ×É(tumor necrosis factor ╬▒, TNF-╬▒), ņØĖĒä░ļŻ©Ēé©-1b (interleukin 1b, IL-1b), IL-6ņØś ļ░®ņČ£ņØä ņ£ĀļÅäĒĢ£ļŗż[47-49]. ņĮöļź┤Ēŗ░ĻĖ░Ļ┤ĆņŚÉņä£ ĒīīņāØļÉ£ ļ¦łņÜ░ņŖż ņäĖĒż ļØ╝ņØĖņØĖ HEI-OC1 ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņ▓śļ”¼ 1ņŗ£Ļ░ä Ēøä ĻĖ░ņĪ┤ ņäĖĒżņŚÉņä£ ņŚ╝ņ”Ø ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ ļČäļ╣äļÉśĻ│Ā, ņØ┤ĒøäņŚÉļŖö ņāłļĪ£ņÜ┤ ļŗ©ļ░▒ ĒĢ®ņä▒ņØä ĒåĄĒĢ┤ ņŚ╝ņ”Ø ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ ļČäļ╣äļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż[47]. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ņŚ╝ņ”ØņØ┤ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØś ņ▓½ļ▓łņ¦Ė Ļ│╝ņĀĢņØ╝ Ļ▓āņØ┤ļØ╝ļŖö Ļ░ĆņäżņØä ļÆĘļ░øņ╣©ĒĢ£ļŗż. ļśÉĒĢ£ 4ņØ╝Ļ░ä 4 mg/kgņØś ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØä ļ│ĄĻ░Ģ ņŻ╝ņé¼ĒĢ£ ļ¦łņÜ░ņŖżņŚÉņä£ļŖö TNF-╬▒, IL-1b ļ░Å IL-6ņØś Ēśłņ▓Ł ņłśņżĆņØ┤ 3-7ļ░░ ņ”ØĻ░ĆĒ¢łņ£╝ļ®░, ņÖĆņÜ░ņŚÉņä£ ļÅÖņØ╝ĒĢ£ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØś mRNA ļ░Å ļŗ©ļ░▒ ņłśņ╣śĻ░Ć ņ”ØĻ░ĆĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż[47]. ĒŖ╣Ē׳, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņ£ĀļÅä TNF-╬▒ ļŗ©ļ░▒ ņłśņ╣śļŖö ņĮöļź┤Ēŗ░ĻĖ░Ļ┤ĆņØś ĒśłĻ┤ĆņĪ░, ļéśņäĀņØĖļīĆ(spiral ligament)ņÖĆ ļéśņäĀņ£żļČĆ(spiral limbus), spiral modiolar veins and lacunaeĻ│╝ ņ£Āļ¬©ņäĖĒżņŚÉņä£ ņ”ØĻ░ĆļÉ©ņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, IL-1bļŖö ņŻ╝ļĪ£ ļéśņäĀ ņØĖļīĆņÖĆ spiral modiolar veins ļ░Å lacunaeņŚÉņä£ ļ░£Ļ▓¼ļÉ£ ļ░śļ®┤, IL-6ļŖö spiral modiolar veins ļ░Å lacunaeņŚÉņä£ļ¦ī ļ░£Ļ▓¼ļÉśņŚłļŗż[47]. ĒĢŁņé░ĒÖöņĀ£ ņĀäņ▓śļ”¼ļź╝ ĒĢ£ HEI-OC1 ņäĖĒżņŚÉņä£ļŖö ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļČäļ╣äĻ░Ć ņśüĒ¢źņØä ļ░øņ¦Ć ņĢŖņĢśļŖöļŹ░, ņØ┤ļŖö ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņ£ĀļÅä ņŚ╝ņ”Øļ░śņØæņØ┤ ĒÖ£ņä▒ņé░ņåīņóģ(reactive oxygen species, ROS)ņØś ļ░£ņāØļ│┤ļŗż ņäĀĒ¢ēĒĢśļŖö ļ░śņØæņ×äņØä ņŗ£ņé¼ĒĢ£ļŗż[47]. ļśÉĒĢ£, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ Ēł¼ņŚ¼ ņĀä TNF-╬▒ļź╝ ņżæĒÖöĒĢśĻ▓ī ļÉśļ®┤ HEI-OC1 ņäĖĒżņØś ņāØņĪ┤ļĀźņØ┤ Ē¢źņāüļÉśņŚłĻ│Ā, UB-OC1 ņäĖĒżņŚÉņä£ļŖö ņäĖĒżņ×Éļ®Ėņé¼Ļ░Ć Ļ░ÉņåīĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░. TNF-╬▒, IL-1b, IL-6ļź╝ ļÅÖņŗ£ņŚÉ ņżæĒÖöĒĢśļŖö Ļ▓ĮņÜ░ņŚÉļŖö HEI-OC1 ņäĖĒżņŚÉņä£ ROS ņāØņé░ņØ┤ Ļ░ÉņåīĒĢśņśĆļŗż[47]. ņØ┤ļŖö ļé┤ņØ┤ņäĖĒżņŚÉņä£ ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ, ņäĖĒżņ×Éļ®Ėņé¼, ROS ņāØņä▒ ņé¼ņØ┤ņŚÉ ļ░ĆņĀæĒĢ£ Ļ┤ĆļĀ©ņØ┤ ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż. HEI-OC1 ņäĖĒżļź╝ ĒåĄĒĢ£ ļśÉļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ nuclear factor kappa-light-chain-enhancer of activated B cells (NF-kB)ņØś ņĀäņ£ä ņ”ØĻ░Ć, TNF-╬▒, IL-6ņØś ņ”ØĻ░Ćļź╝ ĒåĄĒĢ┤ ņŚ╝ņ”Øļ░śņØæņØä ņ”ØĒÅŁņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż[50].
ņĀäņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ(proinflammatory cytokine)ņØś ĒĢ®ņä▒ņØĆ ņŗĀĒśĖļ│ĆĒÖśĻĖ░ņÖĆ ņĀäņé¼ ĒÖ£ņä▒ņØĖņ×É(signal transducer and activator of transcription 1, STAT1)ņØś ĒÖ£ņä▒ņŚÉ ņØśĒĢ┤ ņ┤ēņ¦äļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░, STAT6 (STAT6-/-)Ļ░Ć ļ╣äĒÖ£ņä▒ĒÖöļÉ£ ļ¦łņÜ░ņŖżņØś ņÖĆņÜ░ņäĖĒżņŚÉņä£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ TNF-╬▒, IL-1b ļ░Å IL-6ņØś Ēśłņ▓ŁņłśņżĆ ļ░Å mRNA ļ░£Ēśä, NK-kB mRNAļź╝ ņ”ØĻ░Ćņŗ£Ēéżņ¦Ć ņĢŖņĢśņ£╝ļ®░, ņäĖĒżņ×Éļ®Ėņé¼ ļśÉĒĢ£ ņ£ĀļÅäĒĢśņ¦Ć ņĢŖņĢä, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØ┤ ļ¦żĻ░£ĒĢśļŖö ņĀäņŚ╝ņ”Øļ░śņØæņŚÉņä£ STAT6Ļ░Ć Ļ┤ĆņŚ¼ĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż[50,51]. UB-OC1 ņäĖĒż ņŚ░ĻĄ¼ņŚÉņä£ ĒÖ£ņä▒ĒśĢ STAT1ņØĆ ņŚ╝ņ”Ø ļŗ©ļ░▒ņØĖ cyclooxygenase 2 (COX2), TNF-╬▒, ņ£ĀļÅäņä▒ ņé░ĒÖöņ¦łņåī ĒĢ®ņä▒ ĒÜ©ņåī(inducible nitric oxide synthase, iNOS), ļ®┤ņŚŁņäĖĒżņ╣©ņ£żņØś ļ¦łņ╗żļĪ£ ņĢīļĀżņ¦ä CD14 ļ░Å CD45ņØś ļ░£ĒśäņØä ĒåĄĒĢ┤ ņŚ╝ņ”Øļ░śņØæņØä ņ┤ēņ¦äĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśļ®░, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØä ņŻ╝ņ×ģĒĢ£ ņźÉņØś ĒśłĻ┤ĆņĪ░, ļéśņäĀņØĖļīĆ, ļéśņäĀņ£żļČĆ, ļéśņäĀņŗĀĻ▓ĮņĀł ļ░Å ņÖĖņ£Āļ¬©ņäĖĒżņŚÉņä£ STAT1ņŚÉ ņØśĒĢ┤ ļÅÖņØ╝ĒĢ£ ņŚ╝ņ”Ø ļŗ©ļ░▒Ļ│╝ ļ®┤ņŚŁ ļ¦łņ╗żņØś ņāüņŖ╣ņØ┤ ĒÖĢņØĖļÉśņŚłļŗż[52]. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØ┤ ņÖĆņÜ░ņäĖĒżņŚÉņä£ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļ░®ņČ£ņŚÉ ņ¦üņĀæ ņśüĒ¢źņØä ļ»Ėņ╣śĻ│Ā STAT ļŗ©ļ░▒Ļ│╝ NF-kB ĒÖ£ņä▒ņØä Ļ░ĢĒÖöĒĢśņŚ¼ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ņāØņä▒ņØä ņ×ÉĻĘ╣ĒĢ©ņ£╝ļĪ£ņŹ© ņŚ╝ņ”ØņØä ņ£ĀļÅäĒĢ£ļŗżļŖö Ļ░ĆņäżņØä ļÆĘļ░øņ╣©ĒĢ£ļŗż[52].
ĒÖ£ņä▒ņé░ņåī ņāØņä▒ ļ░Å ņŗĀĒśĖ Ļ▓ĮļĪ£(ROS Generation and Signaling Pathways)ņÖĆņÜ░ļŖö ļīĆņé¼ ĒÖ£ļÅÖņØ┤ ĒÖ£ļ░£ĒĢ£ ĻĖ░Ļ┤Ćņ£╝ļĪ£ņä£, ņÖĆņÜ░ņØś ĒĢŁņé░ĒÖö ņŗ£ņŖżĒģ£ņŚÉļŖö ĻĖĆļŻ©ĒāĆņ╣śņś© ĒŹ╝ņśźņŗ£ļŗżņĀ£, ĻĖĆļŻ©ĒāĆĒŗ░ņś© ĒÖśņøÉĒÜ©ņåī, ĻĖĆļŻ©ĒāĆĒŗ░ņś©-s-ĒŖĖļ×£ņŖżĒŹ╝ļØ╝ņĀ£, ņŖłĒŹ╝ņśźņé¼ņØ┤ļō£ ļööņŖżļ«żĒāĆņĀ£, ņ╣┤ĒāłļØ╝ņĀ£ ļ░Å Ļ░Éļ¦ł-ĻĖĆļŻ©ĒāĆļ░Ć ņŗ£ņŖżĒģīņØĖ ĒĢ®ņä▒ĒÜ©ņåīņÖĆ Ļ░ÖņØĆ ĒÜ©ņåīĻ░Ć ĒżĒĢ©ļÉśļ®░, ĻĘĀĒśĢņĀüņØĖ ĒĢŁņé░ĒÖö ņŗ£ņŖżĒģ£ņØĆ ņÖĆņÜ░ņØś ņĀĢņāüņĀüņØĖ ņāØļ”¼ņÖĆ ņ▓ŁļĀź ņ£Āņ¦ĆņŚÉ ĒĢäņłśņĀüņØĖ ņŚŁĒĢĀņØä ĒĢ£ļŗż. ņÖĆņÜ░ļŖö ņĀĆņé░ņåīņ”ØĻ│╝ ĒŚłĒśł-ņ×¼Ļ┤ĆļźśņŚÉ ļ¦żņÜ░ ļ»╝Ļ░ÉĒĢ£ ĻĖ░Ļ┤Ćņ£╝ļĪ£ Ļ│╝ļÅäĒĢ£ ņåīņØīĻ│╝ ņØ┤ļÅģņä▒ ļ¼╝ņ¦łņØĆ ņÖĆņÜ░ņØś ņé░ĒÖöņŖżĒŖĖļĀłņŖżļź╝ ņ”ØĻ░Ćņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[29]. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØĆ ņÖĆņÜ░ņØś ĒŖ╣ņØ┤ņĀü ĒÖ£ņä▒ņé░ĒśĖ ņ”ØĻ░Ć ĒÜ©ņåīņØĖ NADPH oxidase 3 (NOX3), Ēü¼ņé░Ēŗ┤ ņé░ĒÖöĒÜ©ņåī(xanthin oxidase) ļ░Å ļé┤ņØĖņä▒ ĒĢŁņé░ĒÖö ĒÜ©ņåī ņŗ£ņŖżĒģ£ņØś Ļ░Éņåīļź╝ ĒåĄĒĢ┤ ROSļź╝ ņ”ØĻ░Ćņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ļŗż[7,53-56]. ņÖĆņÜ░ņäĖĒżņŚÉņä£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś ĒØĪņłśļŖö ņĀäņé¼ņØĖņ×É, ņŗĀĒśĖļ│ĆĒÖöņØĖņ×É ļ░Å STAT1ņØä ņ×ÉĻĘ╣ĒĢśņŚ¼ TRPV1Ļ│╝ NOX3 Ļ▓ĮļĪ£ļź╝ ĒÖ£ņä▒ĒÖöĒĢśņŚ¼ ĒÖ£ņä▒ņé░ņåīļź╝ ļÅģņä▒ ņłśņżĆĻ╣īņ¦Ć ļ░£ņāØņŗ£ņ╝£ ņäĖĒż ņé¼ļ®ĖņØä ņ£Āļ░£ĒĢśļ®░, ņØ┤ļŖö ņ£Āļ¬©ņäĖĒżļ┐Éļ¦ī ņĢäļŗłļØ╝ ņ£Āļ¬©ņäĖĒż ĒĢŁņāüņä▒ ņ£Āņ¦ĆņŚÉ ņżæņÜöĒĢ£ ļ╣äĻ░ÉĻ░ü ņÖĆņÜ░ņäĖĒż ļ░Å ļé┤ļ”╝Ēöä ņĀäņ£äļź╝ ņ£Āļ░£ĒĢśļŖö ĒśłĻ┤ĆņĪ░ņØś ņżæĻ░äņäĖĒż(intermediate cell) ļ░Å ļ│ĆņŚ░ņäĖĒż(marginal cell)ļÅä ĒżĒĢ©ļÉ£ļŗż[57-59].
ROS ņāØņä▒ņØĆ ļŗżņ¢æĒĢ£ ĒĢŁņé░ĒÖöņĀ£ ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņ£Āļ░£ ļé£ņ▓ŁņØś ĻĖ░ļ│Ė ĻĖ░ņĀäņ£╝ļĪ£ ņĀ£ņĢłļÉ£ļŗż[60,61]. ņÖĆņÜ░ņäĖĒżņŚÉņä£ ROS ņāØņä▒ņØä ņ£Āļ░£ĒĢśļŖö ņŻ╝ņÜö Ļ│╝ņĀĢņØĆ NADPH ņé░ĒÖöĒÜ©ņåī ņåīļŗ©ņ£äņØś ņāüĒ¢źņĪ░ņĀłļĪ£ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░[62-64], Ļ░ĢĒÖöļÉ£ NADPH ņé░ĒÖöĒÜ©ņåī ĒÖ£ņä▒ņØä ĒåĄĒĢ┤ ņāØņä▒ļÉ£ ROSļŖö NADPH ņé░ĒÖöĒÜ©ņåī ņåīļŗ©ņ£äņØś ĒĢ®ņä▒ņØä ļŗżņŗ£ ņ×ÉĻĘ╣ĒĢśņŚ¼ ņ×ÉĻ░Ć ņ┤ēļ¦ż ļŻ©ĒöäņŚÉņä£ ROS ņāØņé░ņØä ļŹöņÜ▒ ņ”ØĻ░Ćņŗ£Ēé©ļŗż[64]. HEI-OC1 ņäĖĒżņŚ░ĻĄ¼ņŚÉņä£ 6ņŗ£Ļ░ä ļÅÖņĢł 20 mM ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņŚÉ ļģĖņČ£ļÉ£ TNF-╬▒, IL-1b ļ░Å IL-6ļŖö NADPH ņé░ĒÖöĒÜ©ņåī ĒÖ£ņä▒ņØä 20%-50% Ļ░Éņåīņŗ£ņ╝░ņ£╝ļ®░, ļśÉļŗżļźĖ ROS ņāØņä▒ ĒÜ©ņåīņØĖ xanthine oxidaseņØś ĒÖ£ņä▒ņØä ņ”ØĻ░Ćņŗ£Ēé┤ņ£╝ļĪ£ņŹ© ROS ņāØņé░ņØä Ē¢źņāüņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[64,65]. ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉņä£ļŖö 18ņŗ£Ļ░ä ļÅÖņĢł 50 mMņØś ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņ£╝ļĪ£ ņ▓śļ”¼ĒĢ£ HEIOC1 ņäĖĒżņŚÉņä£ ļ│┤ņĪ░ņØĖņ×É ņé¼ņØ┤Ēü┤ļ”░ A (cofactor cyclin A)ņØś ņāüĒ¢źņĪ░ņĀłņØä ĒåĄĒĢ┤ ņé¼ņØ┤Ēü┤ļ”░ ņØśņĪ┤ņä▒ ĒéżļéśņĀ£ 2 (cyclin-dependent kinase 2, CDK2)ĒÖ£ņä▒ņØ┤ 2ļ░░ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØ┤ ļ░ØĒśĆņĪīņ£╝ļ®░, CDK2 ņ¢ĄņĀ£ņĀ£ļĪ£ ņ▓śļ”¼ĒĢ£ ļ¦łņÜ░ņŖż explantņÖĆ CDK2-knockout cochlear ex- plantņŚÉņä£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņ£ĀļÅä ROS ņāØņä▒ ļ░Å ņäĖĒż ņ×Éļ®Ėņé¼Ļ░Ć ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż[66]. ĻĘĖļ¤¼ļéś ņĢäņ¦üĻ╣īņ¦Ć ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØ┤ ņé¼ņØ┤Ēü┤ļ”░ A ļ░Å CDK2 ĒÖ£ņä▒ņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ĻĖ░ņĀäņØĆ ļ¬ģĒÖĢĒ׳ ļ░ØĒśĆņĀĖ ņ׳ņ¦Ć ņĢŖļŗż.
ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņŚÉ ņØśĒĢ┤ ņ”ØĻ░ĆļÉ£ ROSļŖö extracellular signalregulated kinase 1 (ERK1)/STAT1 Ļ▓ĮļĪ£ļź╝ ĒÖ£ņä▒ĒÖöĒĢśņŚ¼ ņŚ╝ņ”ØĻ│╝ ņäĖĒżņ×Éļ®Ėņé¼ņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ļŗ©ļ░▒ņØĖ COX2, TNF-╬▒, iNOS, p53, caspase 3 ļ░Å B-cell lymphoma 2 (Bcl-2)-like protein 4 (BAX)ņØś ļŹö Ļ░ĢĒĢ£ ļ░£ĒśäņØä ņ£Āļ░£ĒĢ£ļŗż[67]. ļśÉĒĢ£ ROSļŖö DNA ņåÉņāüņØä ņØ╝ņ£╝ņ╝£ DNA ļ│ĄĻĄ¼ļŗ©ļ░▒ņ¦ł Ļ│╝ĒÖ£ņä▒ĒÖöļź╝ ņ£Āļ░£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░[68], 16 mg/kgņØś ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØä ņŻ╝ņ×ģĒĢ£ ļ¦łņÜ░ņŖżņØś ņÖĆņÜ░ņŚÉņä£ 4ņØ╝ Ēøä ĒÅ┤ļ”¼ ADP-ļ”¼ļ│┤ņŖż ĒŖĖļ×£ņŖżĒŹ╝ļØ╝ņĀ£ 1(poly-ADP-ribose transferase 1, PARP-1) ĒÖ£ņä▒ņØ┤ 100% ņ”ØĻ░ĆĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż[69]. PARP-1ņØĆ DNA ļ│ĄĻĄ¼ļŗ©ļ░▒ņ¦łņØś ņØ┤ļÅÖņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ĒÜ©ņåīņØ┤ļ®░, ņØ┤ņØś ņ¢ĄņĀ£ļŖö ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņŚÉ ņØśĒĢ£ ņäĖĒż ņé¼ļ®Ė Ļ░ÉņåīņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż[69]. ļśÉĒĢ£, 20 mM ļåŹļÅäņØś ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņ£╝ļĪ£ ņ▓śļ”¼ĒĢ£ HEI-OC1 ņäĖĒżņŚÉņä£ļŖö NAD+/NADH ļ╣äņ£©ņØ┤ ņŗ£Ļ░äņŚÉ ļö░ļØ╝ Ļ░Éņåī(12ņŗ£Ļ░ä Ēøä ļīĆņĪ░ĻĄ░ ļīĆļ╣ä -30% ļ░Å 24ņŗ£Ļ░ä Ēøä -55%)ĒĢśļŖö Ļ▓āņØ┤ ĒÖĢņØĖļÉśņ¢┤, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ļģĖņČ£ ņ▓ŁĻ░üņäĖĒżĻ░Ć DNA ļ│ĄĻĄ¼ ļ®öņ╗żļŗłņ”śņØä ĒÖ£ņä▒ĒÖöĒĢśņ¦Ćļ¦ī DNA ņåÉņāüņØä ņśłļ░®ĒĢĀ ņłś ņŚåņØīņØä ņØśļ»ĖĒĢ£ļŗż[69].
ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØä ņŻ╝ņ×ģĒĢ£ ņźÉņŚÉņä£ ROS ņ£ĀļÅä ņ¦Ćņ¦łĻ│╝ņé░ĒÖö(llipi peroxidation)ļź╝ ĒåĄĒĢ£ ĒĢŁņé░ĒÖö ļ░®ņ¢┤ņŗ£ņŖżĒģ£ņØś Ļ▓░ĒĢŹ ļ░Å ņäĖĒżņåÉņāüņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā, UB-OC1 ņäĖĒżņŚÉņä£ļŖö ņÖĆņÜ░ļŗ©ļ░▒ņ¦łņØś nitrationņØä ĒåĄĒĢ£ ņåÉņāüņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ļæÉ ĻĖ░ņĀä ļ¬©ļæÉ ĻČüĻĘ╣ņĀüņ£╝ļĪ£ ņäĖĒżņ×Éļ®Ėņé¼ļĪ£ ņ¦äĒ¢ēļÉ©ņØ┤ ļ░ØĒśĆņĪīļŗż[70-72].
ņóģĒĢ®ĒĢśļ®┤, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ NADPH ņé░ĒÖöĒÜ©ņåīņÖĆ xanthine oxidase ĒÖ£ņä▒ņØä ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā ĒĢŁņé░ĒÖö ļ░®ņ¢┤ņŗ£ņŖżĒģ£ņØä ļ░®ĒĢ┤ĒĢśļ®░ ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØś ļČäļ╣äļź╝ ņ£ĀļÅäĒĢ©ņ£╝ļĪ£ņŹ© ņÖĆņÜ░ņäĖĒżņŚÉņä£ ROS ņāØņä▒ņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗżļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż. ļśÉĒĢ£ ņ”ØĻ░ĆļÉ£ ROSļŖö ņ¦Ćņ¦ł Ļ│╝ņé░ĒÖö, ļŗ©ļ░▒ņ¦ł ņ¦łĒÖö ļ░Å DNA ņåÉņāüņØä ņ┤ēņ¦äĒĢśĻ│Ā NAD+/NADH ļ╣äņ£©ņØä Ļ░Éņåīņŗ£ņ╝£ Ļ▓░ĻĄŁ ņ▓ŁĻ░ü ņäĖĒż ņé¼ļ®ĖņØä ņ┤łļלĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż[70-72].
ņäĖĒż Ļ│Āņé¼(Cell Death)ņŚ╝ņ”Ø, ROS ņāØņä▒, ER ņŖżĒŖĖļĀłņŖż, DNA ņåÉņāüņØĆ ņäĖĒżņ×Éļ®Ėņé¼ Ļ▓ĮļĪ£ļź╝ ĒÖ£ņä▒ĒÖöĒĢśļŖö ļŹ░ Ļ┤ĆņŚ¼ĒĢ£ļŗż. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØä ņ▓śļ”¼ĒĢ£ explantņŚÉņä£ļŖö ņÖĖņØĖņä▒ ņäĖĒżņ×Éļ®Ėņé¼ Ļ▓ĮļĪ£ņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö Fas-associated protein with death domain (FADD)ņØĆ ļ░£ĒśäĒĢśņ¦Ć ņĢŖļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļéś[73], ļÅÖņØ╝ĒĢ£ Ļ▓ĮļĪ£ņØś ĻĄ¼ņä▒ņÜöņåī ņżæ ĒĢśļéśņØĖ caspase 8ņØĆ ļ░£ĒśäļÉśļŖö ļ¬©ņł£ņĀÉņØ┤ ņ׳ņ¢┤, ņŗ£ņŖżĒöīļØ╝Ēŗ┤Ļ│╝ ņÖĖņØĖņä▒ ņäĖĒżņ×Éļ®Ėņé¼ņŚÉ ļīĆĒĢ£ ĻĖ░ņĀäņØĆ ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ£ ņāüĒā£ņØ┤ļŗż[74]. ņÖĖņØĖņä▒ ņäĖĒżņ×Éļ®Ėņé¼ņÖĆļŖö ļīĆņĪ░ņĀüņ£╝ļĪ£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ļé┤ņØĖņä▒ ņäĖĒżņ×Éļ®Ėņé¼ņÖĆ Ļ┤ĆļĀ©ļÉ£ proapoptotic transcription factor forkhead box O3 (FOXO3a) ļ░Å BAX ļŗ©ļ░▒ņ¦łņØś ļ░£Ēśä ņłśņżĆņØä ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā BAX ļŗ©ļ░▒ņ¦łņØś ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļ¦ēņ£╝ļĪ£ņØś ņĀäņ£äļź╝ ņ┤ēņ¦äĒĢ©ņ£╝ļĪ£ņŹ©, ļé┤ņØĖņä▒ ņäĖĒżņ×Éļ®Ėņé¼ Ļ▓ĮļĪ£ļź╝ ĒÖ£ņä▒ĒÖöĒĢ£ļŗżļŖö ņĀÉņØĆ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ĒÖĢļ”ĮļÉ£ ņé¼ņŗżņØ┤ļŗż[73-75]. ļśÉĒĢ£ ņØ┤ļŖö Bcl-2 ļŗ©ļ░▒ņ¦łņØś Ļ░Éņåī, ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ņÖĖļ¦ēņØś Ēł¼Ļ│╝, ņé¼ņØ┤ĒåĀĒü¼ļĪ¼ cņØś ļ░®ņČ£, ņäĖĒżņ×Éļ®Ėņé¼-ņ£ĀļÅä ņØĖņ×É(apoptosis-inducing factor, AIF)ņØś ļŹö ļåÆņØĆ ļ░£ĒśäņØä ņ£Āļ░£ĒĢśņŚ¼, ņØ┤ļōżņØś ļ░®ņČ£ ļ░Å ĒĢĄņĀäņ£äļź╝ ņ┤ēņ¦äĒĢ£ļŗż[74-77]. ņØ┤ļŖö ļśÉĒĢ£ ņäĖĒżņé¼ļ®Ė ĒöäļĪ£ĒģīņĢäņĀ£ ĒÖ£ņä▒ĒÖöņØĖņ×É 1 (apoptotic protease activating factor 1, APAF-1)ņØś mRNA ļ░Å ļŗ©ļ░▒ņØä ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā, caspase 9 ļ░Å 3ņØś ļ░£Ēśä ļ░Å ĒÖ£ņä▒ņØä ņ”ØĻ░Ćņŗ£Ēéżļ®░[73,76,77], NF-kB ĒĢĄņ£╝ļĪ£ņØś ņĀäņ£äļź╝ ņ┤ēņ¦äĒĢśĻ│Ā, ņĀäņé¼ņØĖņ×ÉņØś ņäĖĒżņ×Éļ®Ėņé¼ ņŚŁĒĢĀņØä ļÅĢļŖöļŗż[77].
ļŗżņ¢æĒĢ£ ņ▓ŁĻ░üņäĖĒż ļ¬©ļŹĖņŚ░ĻĄ¼ņŚÉņä£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ĒÖ£ņä▒ĒśĢ caspase 1ņØä ņ”ØĻ░Ćņŗ£Ēé┤ņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā, ņØ┤ ĒÜ©ņåīļŖö ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ IL-1b ļ░Å IL-18ņØś ņä▒ņłÖ ļ░Å ļČäļ╣äļź╝ ņ┤ēņ¦äĒĢśļŖö ļ│ĄĒĢ®ņ▓┤ņØĖ ņØĖĒöīļØ╝ļ¦łņå£ņØä ĒåĄĒĢ┤ ņäĖĒżņé¼ļ®ĖņØä ņ£ĀļÅäĒĢśļŖö ĒīīņØ┤ļĪŁĒåĀņŗ£ņŖż(pyroptosis) ņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņŚÉ ņØśĒĢ£ ņäĖĒżņé¼ļ®ĖņØ┤ pyroptosisņÖĆļÅä Ļ┤ĆļĀ©ļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż[78,79].
ļśÉĒĢ£ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ņ×ÉĻ░ĆĒżņŗØ(autophagy)ņØś ļ¦łņ╗żļĪ£ ņל ņĢīļĀżņ¦ä Beclin-1, ļ»ĖņäĖņåīĻ┤Ć Ļ┤ĆļĀ© ļŗ©ļ░▒ņ¦ł ņ▓┤ņØĖ(microtubule-associated protein light chain 3, LC3B-II), ļē┤Ēü┤ļĀłņśżĒŗ░ļō£ Ļ▓░ĒĢ® ņś¼ļ”¼Ļ│Āļ©Ė ļÅäļ®öņØĖ, ļźśņŗĀ ĒĢ©ņ£Ā ļ░śļ│Ąņ▓┤ X1 (leucine-rich repeat-containing X1, NLRX1)ņØś ļ░£ĒśäņØä ņ”ØĻ░Ćņŗ£ņ╝£, ņäĖĒżņ¦łņŚÉ ņ×ÉĻ░ĆĒżņŗØņåīņ▓┤ļź╝ ņČĢņĀüĒĢśņŚ¼ ņäĖĒżņ×Éļ®Ėņé¼ņÖĆļŖö ļÅģļ”ĮņĀüņ£╝ļĪ£ ņ×ÉĻ░ĆĒżņŗØņäĖĒżļź╝ ņé¼ļ®Ėņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż[80-82].
ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ Ļ┤┤ņé¼(necroptosis: a caspase-independent pathway of programmed necrosis)ļÅä ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒Ļ│╝ Ļ┤ĆļĀ©ļÉĀ ņłś ņ׳ņØīņØ┤ ņĢīļĀżņĪīļŖöļŹ░, 16 mg/kg ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØä ļ│ĄĻ░Ģ ļé┤ ņŻ╝ņ×ģĒĢ£ ņźÉņØś ņÖĆņÜ░ņŚÉņä£ ņłśņÜ®ņ▓┤-ņāüĒśĖņ×æņÜ® ņäĖļ”░/ĒŖĖļĀłņśżļŗī-ļŗ©ļ░▒ņ¦ł ĒéżļéśņĀ£1 (receptor-interacting serine/threonine-protein kinase 1, RIPK1)ņØś ļ░£ĒśäņØ┤ 100% ņ”ØĻ░ĆļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż[83]. RIPK1ņØĆ RIPK3Ļ│╝ ĒĢ©Ļ╗ś ripoptosomeņØä ĒśĢņä▒ĒĢśņŚ¼ Ļ┤┤ņé¼ļź╝ ņ£Āļ░£ĒĢśļŖö ļ¼╝ņ¦łļĪ£[84], ļ®┤ņŚŁņĪ░ņ¦üĒÖöĒĢÖ ļČäņäØ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļéśņäĀņŗĀĻ▓ĮņĀł, ļé┤ņ£Āļ¬©ņäĖĒżņÖĆ ņÖĖņÜ░ļ¬©ņäĖĒżņØś ļē┤ļ¤░ņŚÉņä£ RIPK3 ļŗ©ļ░▒ ļ░£ĒśäņØ┤ ņ”ØĻ░ĆļÉ©ņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā[83], ļśÉļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļŖö RIPK1ņØä ņĢĮļ”¼ĒĢÖņĀüņ£╝ļĪ£ ņ¢ĄņĀ£ĒĢśņŚ¼ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ Ļ┤ĆļĀ© ņ▓ŁļĀź ņāüņŗżļĪ£ļČĆĒä░ ļ¦łņÜ░ņŖżļź╝ ļ│┤ĒśĖĒĢśņŚ¼ ABR ņŚŁņ╣śļź╝ 30 dB Ē¢źņāüņŗ£ĒéżļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż[85]. RIPK3-knock out ļ¦łņÜ░ņŖżņÖĆ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņ£╝ļĪ£ ņ▓śļ”¼ļÉ£ Ripk3/caspase 8 double knockout ļ¦łņÜ░ņŖżļŖö ņ£Āļ¬©ņäĖĒż ņāØņĪ┤Ļ│╝ ņ▓ŁļĀź ņŚŁņ╣ś(10 dB)ņŚÉņä£ ņāüļŗ╣ĒĢ£ Ļ░£ņäĀņØä ļ│┤ņØ┤ĻĖ░ļÅä ĒĢśņśĆļŗż[85]. ņØ╝ļČĆņŚÉņä£ļŖö ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØ┤ caspase 8ņŚÉ ņØśĒĢ┤ ļ¦żĻ░£ļÉśļŖö ņäĖĒżņ×Éļ®Ėņé¼ļ│┤ļŗż ņÖĆņÜ░ņäĖĒżņØś Ļ┤┤ņé¼ ņ┤ēņ¦äņØ┤ ņØ┤ļÅģņä▒ņŚÉ ļŹö ĻĖ░ņŚ¼ĒĢĀ Ļ▓āņØ┤ļØ╝Ļ│Ā ņŻ╝ņןĒĢśĻĖ░ļÅä ĒĢśļéś, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņŚÉņä£ņØś Ļ┤┤ņé¼ ĻĖ░ņĀäņØś ņŚŁĒĢĀņØĆ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ£ ņāüĒā£ņØ┤ļŗż.
ņØ┤ļÅģņä▒ ņĢģĒÖö ņ£äĒŚśņØä ļåÆņØ┤ļŖö ņÜöņØĖņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØä Ē¢źņāüņŗ£ĒéżļŖö ņ£äĒŚśņÜöņåīņŚÉļŖö ņŗĀļČĆņĀä ļ░Å Ēāłņłś, ņśüņ¢æ ņŗżņĪ░ ļō▒ņØ┤ ņ׳ņ£╝ļ®░, ĒśłņĢĪ-ļćī ņןļ▓Į(blood-brain barrier) ņØä ĒīīĻ┤┤ĒĢśļŖö ĒöäļĪ£ĒåĀņĮ£ņØś ņé¼ņÜ®ņØĆ ĒśłņĢĪ-ļ»ĖļĪ£ ņןļ▓Į(BLB) ļśÉĒĢ£ ĒīīĻ┤┤ĒĢ©ņ£╝ļĪ£ņŹ© ņØ┤ļÅģņä▒ņØś ņ£äĒŚśņØä ļåÆņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ļŗż[86,87]. ņ¦Ćņ¦łļŗżļŗ╣ļźś(lipopolysaccharide, LPS)ļĪ£ ņ£ĀļÅäļÉ£ Ēī©Ēśłņ”Ø ļÅÖļ¼╝ļ¬©ļŹĖņŚÉņä£ ņØ┤ļÅģņä▒ņØś ņĢģĒÖöĻ░Ć ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŖöļŹ░[88], LPSļŖö ņØ╝ļ░śņĀüņ£╝ļĪ£ toll-like receptor 4 (TLR4)ņŚÉ Ļ▓░ĒĢ®ĒĢśņŚ¼ ļé┤ņØĖņä▒ ņåÉņāü Ļ┤ĆļĀ© ļČäņ×ÉĒī©Ēä┤ņØä ņØĖņŗØĒĢśĻ│Ā ņŚ╝ņ”Øļ░śņØæņØä ņ£ĀļÅäĒĢśļŖö ļ¼╝ņ¦łļĪ£ņä£, ņŚ╝ņ”ØĻ│╝ņĀĢņŚÉņä£ ņØ┤ļÅģņä▒ņØś ņĢģĒÖöļź╝ ņØ╝ņ£╝Ēé© Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[89]. ļśÉĒĢ£, ņ£äņןĻ┤Ć ļ░®ņé¼ņäĀņ╣śļŻīļź╝ ĒĢ©Ļ╗ś ĒĢśļŖö Ļ▓ĮņÜ░ ļ░®ņé¼ņäĀ ņĪ░ņé¼ļŖö Ļ│ĄņāØļ░ĢĒģīļ”¼ņĢäļź╝ ļ░Ģļ®ĖĒĢśĻ│Ā, LPSņØś ĒśłņżæļåŹļÅäļź╝ ļåÆņ×äņ£╝ļĪ£ņŹ© LPS ņ£ĀļÅä ņŚ╝ņ”Øļ░śņØæņØ┤ ļ░£ņāØĒĢśĻĖ░ļÅä ĒĢ┤, ļæÉĻ▓ĮļČĆ ļ░®ņé¼ņäĀ ļ│æņÜ® ņ╣śļŻī ņÖĖņŚÉļÅä ņØ┤ļÅģņä▒ņØś ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£Ēé¼ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[90].
ĒŖ╣ņĀĢ ņ£ĀņĀäņĀü ņåīņØĖ ļśÉĒĢ£ Ļ░£ņØĖņØś ņØ┤ļÅģņä▒ Ļ░Éņłśņä▒ņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░, ERCC2ņÖĆ XPCņ▓śļ¤╝ DNA ļ│ĄĻĄ¼ ĒÜ©ņåīņŚÉ Ļ┤ĆĒĢ£ ņ£ĀņĀäņ×ÉņØś ļ│ĆņØ┤ ļśÉļŖö ĒĢŁņé░ĒÖö ĒÜ©ņåīļéś, ņĢĮļ¼╝ ņ£ĀņČ£ ļśÉļŖö ņäĖĒżļ¦ē ĒÄīĒöäņÖĆ Ļ┤ĆļĀ©ļÉ£ ABCC3, ACYP2 , COMT, TPMTņØś ļ│ĆņØ┤Ļ░Ć ņØ┤ņŚÉ ĒżĒĢ©ļÉ£ļŗż(Table 1) [91,92]. ĻĘĖļ¤¼ļéś ņĄ£ĻĘ╝ņŚÉļŖö ņØ┤ļ¤¼ĒĢ£ ņ£ĀņĀäņĀü ņåīņØĖņØä ĒåĄĒĢ£ ņØ┤ļÅģņä▒ ļé£ņ▓Ł ļ░£ņāØ ņśłņĖĪļ╣äņ£©ņØ┤ ņāüļīĆņĀüņ£╝ļĪ£ ļåÆņ¦Ć ņĢŖņ£╝ļ®░, ņśżĒ׳ļĀż ņל ņĢīļĀżņĀĖ ņ׳ļŖö ņØ┤ļÅģņä▒ ņĢĮņĀ£ņØĖ ņĢäļ»ĖļģĖĻĖĆļ”¼ņĮöņé¼ņØ┤ļō£ņÖĆ ņØ┤ļć©ņĀ£ ļō▒ņØś ņĢĮņĀ£ Ēł¼ņŚ¼ļéś ļæÉĻ▓ĮļČĆ ļ░®ņé¼ņäĀ ņĪ░ņé¼ļź╝ ļÅÖļ░śĒĢ£ Ļ▓ĮņÜ░ ņåīņØī ļģĖņČ£ ļō▒ņŚÉņä£ ņØ┤ļÅģņä▒ ļé£ņ▓Ł ļ╣äņ£©ņØ┤ ļåÆņØīņØ┤ ņĢīļĀżņĀĖ ņ׳ļŗż[59,93,94].
ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØä ļ¦ēĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØä ņśłļ░®ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö Ļ│ĀņŻ╝Ēīī ņ▓ŁļĀźĻ▓Ćņé¼ ļ░Å distortion product otoacoustic emission (DPOAE) ļō▒ņØś ņĀĢĻĖ░ņĀüņØĖ Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ£ ļé£ņ▓ŁņØś ņĪ░ĻĖ░ ļ░£Ļ▓¼ņØ┤ ļÅäņøĆņØ┤ ļÉśļ®░, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņØä Ļ░Éņåīņŗ£ĒéżļŖö ļ░®ļ▓Ģņ£╝ļĪ£ Ļ│ĀņןņĢĪ ņŗØņŚ╝ņłśņØś ņĀäņ▓śņ╣śĻ░Ć ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ ļÅģņä▒ņØ┤ ņĀüņØĖ 2ņäĖļīĆ ņĢĮļ¼╝ņØĖ carboplatinņ£╝ļĪ£ņØś ļīĆņ▓┤ Ēł¼ņŚ¼ļź╝ ĒĢśĻĖ░ļÅä ĒĢ£ļŗż. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ĒĢŁņĢöņĀ£ņØś ņØ┤ļÅģņä▒ ĻĖ░ņĀäņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ¦äĒ¢ēļÉśļ®┤ņä£, ņäĖĒż ņé¼ļ®ĖņØś ņ¢ĄņĀ£, ĒÖ£ņä▒ĒÖö ņé░ĒśĖņØś ņżæĒÖö, ņŚ╝ņ”Ø ļ░śņØæņØś ņ¢ĄņĀ£ ļō▒ ņ×Āņ×¼ņĀü ļ│┤ĒśĖ Ļ░ĆļŖźņä▒ņØä ņ¦Ćļŗī ņĢĮļ¼╝ņØś ņŗ£ļÅäņÖĆ ņŚ░ĻĄ¼Ļ░Ć ņ׳ņŚłļŗż. ļīĆļČĆļČäņØś ņĀäņ×äņāü ļ░Å ņ×äņāüņŗ£ĒŚśņŚÉņä£ņØś ņØ┤ļÅģņä▒ ļ│┤ĒśĖ ņĢĮļ¼╝ņØĆ ĒĢŁņé░ĒÖöņĀ£ ļ░Å ĒĢŁņŚ╝ņ”ØņĀ£ ļ▓öņŻ╝ņŚÉ ņåŹĒĢśļ®░, ņØ┤ņŚÉ Ļ┤ĆļĀ©ĒĢ£ Ļ▓ĮļĪ£ ņżæ ĒĢśļéś ļśÉļŖö ļæś ļ¬©ļæÉļź╝ ņ¢ĄņĀ£ĒĢśļŖö ĻĖ░ņĀäņ£╝ļĪ£ ņ×æņÜ®ĒĢ£ļŗż. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØä ņŻ╝ņ×ģĒĢ£ ņŚ¼ļ¤¼ ļÅÖļ¼╝ ļ¬©ļŹĖņŚÉņä£ ĒĢŁņé░ĒÖöņĀ£ņØĖ apocynin, lactage, alpha lipoic acids ļō▒, ĒĢŁņŚ╝ņ”Ø ņ×æņÜ®ņØä ļÅÖņŗ£ņŚÉ ĒĢśļŖö flunarizine, hydrogen, N-acetylcystein ļ░Å ņäĖĒżņ×Éļ®Ėņé¼ņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖö pifithrin-a, minocycline ļō▒ņØś ņ▓śļ”¼ņŗ£ ņ▓ŁļĀź ņŚŁņ╣śņØś ņāüņŖ╣ ļ░Å ņ£Āļ¬©ņäĖĒż ņåÉņāüņØś Ļ░Éņåīļź╝ ĒÖĢņØĖĒĢśņśĆļŗż(Table 2). ņ×äņāüņŚÉņä£ļŖö thiamin, cyanin ļ░Å ņŗżĒŚśņĀüņ£╝ļĪ£ sodium thiosulfate, lazaroid ļō▒ņØ┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ņ£╝ļéś, Ēśäņ×¼Ļ╣īņ¦Ć FDA ņŖ╣ņØĖņØä ļ░øņØĆ ņĢĮļ¼╝ņØĆ ņŚåļŖö ņāüĒā£ņØ┤ļŗż.
Ļ▓░ ļĪĀņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØĆ ņĢöĒÖśņ×ÉņØś ņāØļ¬ģņØä ĻĄ¼ĒĢśļŖö ļīĆĒæ£ņĀüņØĖ ĒĢŁņĢöņĀ£ļĪ£ņä£ņØś ņŚŁĒĢĀņØä ĒĢśņ¦Ćļ¦ī ļ╣äĻ░ĆņŚŁņĀü Ļ░ÉĻ░üņŗĀĻ▓Įņä▒ ļé£ņ▓ŁņØä ņ£Āļ░£ĒĢśļŖö ņØ┤ļÅģņä▒ ļśÉĒĢ£ ļé┤ĒżĒĢśļŖö ņĢĮņĀ£ņØ┤ļŗż. ņŚ╝ņ”ØņØĆ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ļģĖņČ£ Ēøä ņ▓śņØīņ£╝ļĪ£ ņ┤ēļ░£ļÉśļŖö ļ░śņØæņØ┤ļ®░, ņé░ĒÖöņŖżĒŖĖļĀłņŖżņÖĆ ROS ņāØņä▒ņ£╝ļĪ£ ņØ┤ņ¢┤ņ¦ĆļŖö ņØ╝ļĀ©ņØś ļ░śņØæņØä ņ£Āļ░£ĒĢ£ļŗż. ROSļŖö ņ¦Ćņ¦łņØś Ļ│╝ņé░ĒÖö, ļŗ©ļ░▒ņ¦ł ņ¦łĒÖö, DNA ļ│ĆĻ▓Į ļ░Å ņŚ╝ņ”Ø Ļ│╝ņĀĢņØś ņ”ØĒÅŁņØä ĒåĄĒĢ┤ ņäĖĒż ņåÉņāüņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ņ£╝ļ®░, ņÖĆņÜ░ņäĖĒżļŖö ļŗ©ļ░▒ņ¦ł ļ░Å DNA ļ│ĄĻĄ¼ ļ®öņ╗żļŗłņ”śņØä ĒÖ£ņä▒ĒÖöĒĢśņŚ¼, ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś ļÅģņä▒ņ£╝ļĪ£ļČĆĒä░ ĒĢŁņāüņä▒ņØä ĒÜīļ│ĄĒĢśĻĖ░ ņ£äĒĢ£ ļģĖļĀźņØä ĒĢ£ļŗż. ĻĘĖļ¤¼ļéś, ROSļĪ£ ņØĖĒĢ┤ ņ£ĀļÅäļÉ£ ņäĖĒżņØś ņåÉņāüņŚÉ ļīĆĒĢ£ ļ░®ņ¢┤ ņŗ£ņŖżĒģ£ņØś ņŗżĒī©ļŖö Ļ▓░ĻĄŁ ņäĖĒż ņé¼ļ®ĖļĪ£ ņØ┤ņ¢┤ņ¦ĆĻ▓ī ļÉśļ®░, ļé┤ņØĖņä▒ ņäĖĒżņ×Éļ®Ėņé¼, pyroptosis, ņ×ÉĻ░ĆĒżņŗØ ļ░Å necroptosis ļśÉĒĢ£ ņØ┤ņŚÉ Ļ┤ĆņŚ¼ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
Ēśäņ×¼Ļ╣īņ¦Ć ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ņŚÉ ļīĆĒĢ£ ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśņŚłņ£╝ļéś, ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņØś ļģ╝ļ×ĆņØ┤ ņ׳Ļ▒░ļéś ļČłņÖäņĀäĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, ņØ┤ļÅģņä▒ņŚÉ ļīĆĒĢ£ ļ│┤ĒÄĖņĀüņØĖ ņ▓ŁļĀź ĒÅēĻ░Ć ļ░Å ņØ┤ļÅģņä▒ ļō▒ĻĖēņŚÉ ļīĆĒĢ£ Ēæ£ņżĆĒÖöļÉ£ ņ¦Ćņ╣©ņØ┤ ņŚåļŖö ņāüĒā£ļĪ£, ņ×äņāü ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ņØś ĒĢ┤ņäØņŚÉ ņ׳ņ¢┤ņä£ļÅä ļģ╝ļ×ĆņØ┤ ņ׳ļŖö ņāüĒā£ņØ┤ļŗż.
ļö░ļØ╝ņä£ Ē¢źĒøä ņŚ░ĻĄ¼ļŖö ņŗ£ņŖżĒöīļØ╝Ēŗ┤ņØś ņ╣śļŻī ĒÜ©ļŖźņØä ļ░®ĒĢ┤ĒĢśņ¦Ć ņĢŖņ£╝ļ®┤ņä£, ļŗżņ¢æĒĢ£ ĒÖ£ņä▒ Ļ▓ĮļĪ£ļź╝ ņ¢ĄņĀ£ĒĢśļŖö ļ│ĄĒĢ® ņĢĮļ¼╝ ņé¼ņÜ® ļ░Å ĒÜ©Ļ│╝ņĀüņØĖ ĻĄŁņåī ņÜöļ▓ĢņØś Ļ░£ļ░£ņØä Ļ│ĀļĀżĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢĀ ņłś ņ׳ļŗż. ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņØ┤ļÅģņä▒ ĻĖ░ņĀäņŚÉ ļīĆĒĢ£ ļŹö Ļ╣ŖņØĆ ņØ┤ĒĢ┤ļŖö Ē¢źĒøä ņŚ░ĻĄ¼ņ×ÉļōżņØ┤ ņŗ£ņŖżĒöīļØ╝Ēŗ┤ ņĢĮļ¼╝ ņ×æņÜ® ĻĖ░ņĀäņØä ļ╣äĒÖ£ņä▒ĒÖöĒĢśļŖö Ēæ£ņĀü ņŚ░ĻĄ¼ļź╝ ĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
ACKNOWLEDGMENTSThis research was supported by Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education (2021R1F1A1052136).
Fig.┬Ā1.Cochlear trafficking routes for systemically administered cisplatin. Blood-borne cisplatin enter the cochlea primarily from the capillaries in the stria vascularis. Cisplatin enters endolymph potentially trafficking through OCT2 and CTR1 transporters in the marginal cells. From the endolymph, these ototoxin enters the hair cell across their apical membranes. OCT2, organic cation transporter-2; CTR1, copper-like transport-1; TMC1, transmembrane channel-like protein-1. Adapted from Kros and Steyger. Cold Spring Harb Perspect Med 2019;9(11):a033548 [109]. 
Fig.┬Ā2.Hypothesized mechanism of cisplatin-induced ROS production and related signaling in cochlear cells. Cisplatin induce ROS production in cochlear cells by promoting the release of proinflammatory cytokines, increasing the activity of NADPH oxidases and xanthine oxidase, and depleting the antioxidant defense system. Generated ROS by cisplatin promote inflammation, ROS generation, lipid peroxidation, protein nitration, and apoptosis. BAX, Bcl-2-like protein 4; Bcl2, B-cell lymphoma 2; COX2, cyclooxygenase 2; ERK1, extracellular signal-regulated kinase 1; iNOS, inducible nitric oxide synthase; IL, interleukin; NO, nitric oxide; ROS, reactive oxygen species; STAT1, signal transducer and activator of transcription 1; TNF-╬▒, tumor necrosis factor ╬▒; APAF, apoptotic protease activating factor. Adapted from Gentilin, et al. Trends Mol Med 2019;25(12):1123-32, with permission of Elsevier Ltd [110]. 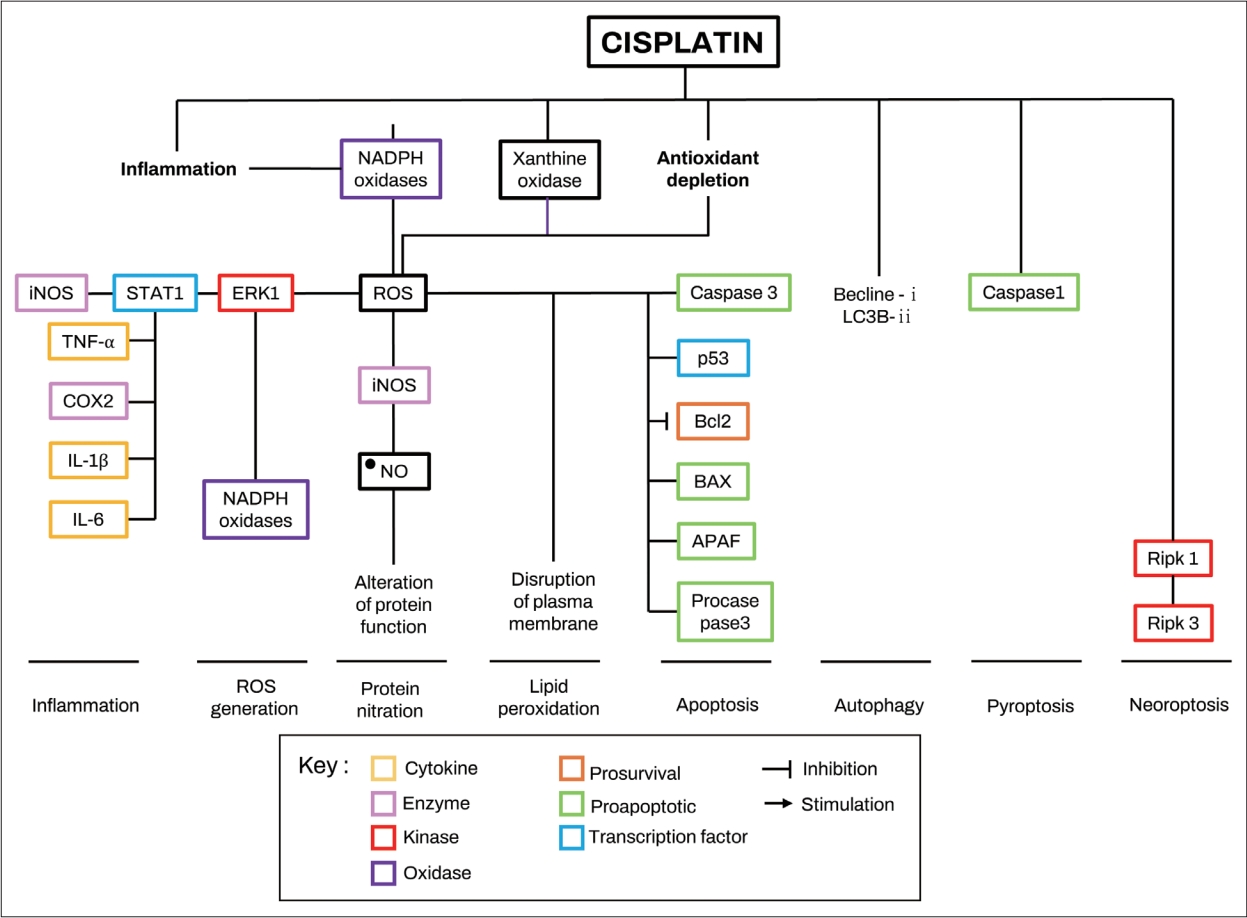
Table┬Ā1.Summary of vulnerable gene to cisplatin ototoxicity Table┬Ā2.Summary of otoprotective drug on cisplatin ototoxicity in various animal models
REFERENCES1. Fleischman RW, Stadnicki SW, Ethier MF, Schaeppi U. Ototoxicity of cis-dichlorodiammine platinum (II) in the guinea pig. Toxicol Appl Pharmacol 1975;33(2):320-32.
2. Kohn S, Fradis M, Pratt H, Zidan J, Podoshin L, Robinson E, et al. Cisplatin ototoxicity in guinea pigs with special reference to toxic effects in the stria vascularis. Laryngoscope 1988;98(8 Pt 1):865-71.
3. Skinner R, Pearson AD, English MW, Price L, Wyllie RA, Coulthard MG, et al. Cisplatin dose rate as a risk factor for nephrotoxicity in children. Br J Cancer 1998;77(10):1677-82.
4. Knight KR, Kraemer DF, Neuwelt EA. Ototoxicity in children receiving platinum chemotherapy: Underestimating a commonly occurring toxicity that may inf luence academic and social development. J Clin Oncol 2005;23(34):8588-96.
5. Knight KR, Kraemer DF, Winter C, Neuwelt EA. Early changes in auditory function as a result of platinum chemotherapy: Use of extended high-frequency audiometry and evoked distortion product otoacoustic emissions. J Clin Oncol 2007;25(10):1190-5.
6. Chirtes F, Albu S. Prevention and restoration of hearing loss associated with the use of cisplatin. Biomed Res Int 2014;2014:925485.
7. Rybak LP. Mechanisms of cisplatin ototoxicity and progress in otoprotection. Curr Opin Otolaryngol Head Neck Surg 2007;15(5):364-9.
8. Schweitzer VG. Ototoxicity of chemotherapeutic agents. Otolaryngol Clin North Am 1993;26(5):759-89.
9. Barron SE, Daigneault EA. Effect of cisplatin on hair cell morphology and lateral wall Na,K-ATPase activity. Hear Res 1987;26(2):131-7.
10. Alderden RA, Hall MD, Hambley TW. The discovery and development of cisplatin. J Chem Educ 2006;83(5):728.
11. Muggia FM, Bonetti A, Hoeschele JD, Rozencweig M, Howell SB. Platinum antitumor complexes: 50 years since Barnett RosenbergŌĆÖs discovery. J Clin Oncol 2015;33(35):4219-26.
12. Rosenberg B, Van Camp L, Grimley EB, Thomson AJ. The inhibition of growth or cell division in Escherichia coli by different ionic species of platinum(IV) complexes. J Biol Chem 1967;242(6):1347-52.
13. Rosenberg B, VanCamp L, Trosko JE, Mansour VH. Platinum compounds: A new class of potent antitumour agents. Nature 1969;222(5191):385-6.
15. Lebwohl D, Canetta R. Clinical development of platinum complexes in cancer therapy: An historical perspective and an update. Eur J Cancer 1998;34(10):1522-34.
16. Sorenson CM, Eastman A. Mechanismofcis-diamminedichloroplatinum(II)-induced cytotoxicity: Role of G2 arrest and DNA double-strand breaks. Cancer Res 1988;48(16):4484-8.
17. Cepeda V, Fuertes MA, Castilla J, Alonso C, Quevedo C, P├®rez JM. Biochemical mechanisms of cisplatin cytotoxicity. Anticancer Agents Med Chem 2007;7(1):3-18.
18. Gonzalez VM, Fuertes MA, Alonso C, Perez JM. Is cisplatininduced cell death always produced by apoptosis? Mol Pharmacol 2001;59(4):657-63.
19. Xu Y, Ma HB, Fang YL, Zhang ZR, Shao J, Hong M, et al. Cisplatin-induced necroptosis in TNF╬▒ dependent and independent pathways. Cell Signal 2017;31:112-23.
20. Yu W, Chen Y, Dubrulle J, Stossi F, Putluri V, Sreekumar A, et al. Cisplatin generates oxidative stress which is accompanied by rapid shifts in central carbon metabolism. Sci Rep 2018;8(1):4306.
21. Dixon SJ, Lemberg KM, Lamprecht MR, Skouta R, Zaitsev EM, Gleason CE, et al. Ferroptosis: An iron-dependent form of nonapoptotic cell death. Cell 2012;149(5):1060-72.
22. Vandenabeele P, Galluzzi L, Vanden Berghe T, Kroemer G. Molecular mechanisms of necroptosis: An ordered cellular explosion. Nat Rev Mol Cell Biol 2010;11(10):700-14.
23. Brock PR, Knight KR, Freyer DR, Campbell KC, Steyger PS, Blakley BW, et al. Platinum-induced ototoxicity in children: A consensus review on mechanisms, predisposition, and protection, including a new International Society of Pediatric Oncology Boston ototoxicity scale. J Clin Oncol 2012;30(19):2408-17.
24. Garinis AC, Cross CP, Srikanth P, Carroll K, Feeney MP, Keefe DH, et al. The cumulative effects of intravenous antibiotic treatments on hearing in patients with cystic fibrosis. J Cyst Fibros 2017;16(3):401-9.
25. Garinis AC, Liao S, Cross CP, Galati J, Middaugh JL, Mace JC, et al. Effect of gentamicin and levels of ambient sound on hearing screening outcomes in the neonatal intensive care unit: A pilot study. Int J Pediatr Otorhinolaryngol 2017;97:42-50.
26. Ram├Łrez-Camacho R, Garc├Ła-Berrocal JR, Buj├Īn J, Mart├Łn-Marero A, Trinidad A. Supporting cells as a target of cisplatin-induced inner ear damage: Therapeutic implications. Laryngoscope 2004;114(3):533-7.
27. Jadali A, Ying YM, Kwan KY. Activation of CHK1 in supporting cells indirectly promotes hair cell survival. Front Cell Neurosci 2017;11:137.
28. Wu X, Li X, Song Y, Li H, Bai X, Liu W, et al. Allicin protects auditory hair cells and spiral ganglion neurons from cisplatin -Induced apoptosis. Neuropharmacology 2017;116:429-40.
29. Schacht J, Talaska AE, Rybak LP. Cisplatin and aminoglycoside antibiotics: Hearing loss and its prevention. Anat Rec (Hoboken) 2012;295(11):1837-50.
30. Cheng PW, Liu SH, Hsu CJ, Lin-Shiau SY. Correlation of increased activities of Na+, K+-ATPase and Ca2+-ATPase with the reversal of cisplatin ototoxicity induced by D-methionine in guinea pigs. Hear Res 2005;205(1-2):102-9.
31. Breglio AM, Rusheen AE, Shide ED, Fernandez KA, Spielbauer KK, McLachlin KM, et al. Cisplatin is retained in the cochlea indefinitely following chemotherapy. Nat Commun 2017;8(1):1654.
32. Chu YH, Sibrian-Vazquez M, Escobedo JO, Phillips AR, Dickey DT, Wang Q, et al. Systemic delivery and biodistribution of cisplatin in vivo. Mol Pharm 2016;13(8):2677-82.
33. van Ruijven MW, de Groot JC, Hendriksen F, Smoorenburg GF. Immunohistochemical detection of platinated DNA in the cochlea of cisplatin-treated guinea pigs. Hear Res 2005;203(1-2):112-21.
34. Ciarimboli G, Deuster D, Knief A, Sperling M, Holtkamp M, Edemir B, et al. Organic cation transporter 2 mediates cisplatininduced oto- and nephrotoxicity and is a target for protective interventions. Am J Pathol 2010;176(3):1169-80.
35. More SS, Akil O, Ianculescu AG, Geier EG, Lustig LR, Giacomini KM. Role of the copper transporter, CTR1, in platinum-induced ototoxicity. J Neurosci 2010;30(28):9500-9.
36. Waissbluth S, Daniel SJ. Cisplatin-induced ototoxicity: Transporters playing a role in cisplatin toxicity. Hear Res 2013;299:37-45.
37. Hiel H, Erre JP, Aurousseau C, Bouali R, Dulon D, Aran JM. Gentamicin uptake by cochlear hair cells precedes hearing impairment during chronic treatment. Audiology 1993;32(1):78-87.
38. Hall MD, Okabe M, Shen DW, Liang XJ, Gottesman MM. The role of cellular accumulation in determining sensitivity to platinumbased chemotherapy. Annu Rev Pharmacol Toxicol 2008;48:495-535.
39. Alharazneh A, Luk L, Huth M, Monfared A, Steyger PS, Cheng AG, et al. Functional hair cell mechanotransducer channels are required for aminoglycoside ototoxicity. PLoS One 2011;6(7):e22347.
40. Pan B, Akyuz N, Liu XP, Asai Y, Nist-Lund C, Kurima K, et al. TMC1 forms the pore of mechanosensory transduction channels in vertebrate inner ear hair cells. Neuron 2018;99(4):736-53, e6.
41. Thomas AJ, Hailey DW, Stawicki TM, Wu P, Coffin AB, Rubel EW, et al. Functional mechanotransduction is required for cisplatin-induced hair cell death in the zebrafish lateral line. J Neurosci 2013;33(10):4405-14.
42. Eljack ND, Ma HY, Drucker J, Shen C, Hambley TW, New EJ, et al. Mechanisms of cell uptake and toxicity of the anticancer drug cisplatin. Metallomics 2014;6(11):2126-33.
43. Jiang M, Karasawa T, Steyger PS. Aminoglycoside-induced cochleotoxicity: A review. Front Cell Neurosci 2017;11:308.
44. Karasawa T, Steyger PS. An integrated view of cisplatin-induced nephrotoxicity and ototoxicity. Toxicol Lett 2015;237(3):219-27.
45. Eastman A. The mechanism of action of cisplatin: from adducts to apoptosis. In: Lippert B, ed. Cisplatin: chemistry and biochemistry of a leading anticancer drug. Z├╝rich: Verlag Helvetica Chimica Acta; 1999. p. 111-34.
46. Karasawa T, Sibrian-Vazquez M, Strongin RM, Steyger PS. Identification of cisplatin-binding proteins using agarose conjugates of platinum compounds. PLoS One 2013;8(6):e66220.
47. So H, Kim H, Lee JH, Park C, Kim Y, Kim E, et al. Cisplatin cytotoxicity of auditory cells requires secretions of proinflammatory cytokines via activation of ERK and NF-kappaB. J Assoc Res Otolaryngol 2007;8(3):338-55.
48. Kim SJ, Kwak HJ, Kim DS, Choi HM, Sim JE, Kim SH, et al. Protective mechanism of Korean Red Ginseng in cisplatin-induced ototoxicity through attenuation of nuclear factor-╬║B and caspase-1 activation. Mol Med Rep 2015;12(1):315-22.
49. Levano S, Bodmer D. Loss of STAT1 protects hair cells from ototoxicity through modulation of STAT3, c-Jun, Akt, and autophagy factors. Cell Death Dis 2015;6(12):e2019.
50. Kim HJ, Oh GS, Lee JH, Lyu AR, Ji HM, Lee SH, et al. Cisplatin ototoxicity involves cytokines and STAT6 signaling network. Cell Res 2011;21(6):944-56.
51. Turner MD, Nedjai B, Hurst T, Pennington DJ. Cytokines and chemokines: At the crossroads of cell signalling and inflammatory disease. Biochim Biophys Acta 2014;1843(11):2563-82.
52. Kaur T, Mukherjea D, Sheehan K, Jajoo S, Rybak LP, Ramkumar V. Short interfering RNA against STAT1 attenuates cisplatininduced ototoxicity in the rat by suppressing inflammation. Cell Death Dis 2011;2(7):e180.
53. Kopke RD, Liu W, Gabaizadeh R, Jacono A, Feghali J, Spray D, et al. Use of organotypic cultures of CortiŌĆÖs organ to study the protective effects of antioxidant molecules on cisplatin-induced damage of auditory hair cells. Am J Otol 1997;18(5):559-71.
54. B├Īnfi B, Malgrange B, Knisz J, Steger K, Dubois-Dauphin M, Krause KH. NOX3, a superoxide-generating NADPH oxidase of the inner ear. J Biol Chem 2004;279(44):46065-72.
55. Church MW, Kaltenbach JA, Blakley BW, Burgio DL. The comparative effects of sodium thiosulfate, diethyldithiocarbamate, fosfomycin and WR-2721 on ameliorating cisplatin-induced ototoxicity. Hear Res 1995;86(1-2):195-203.
56. Lynch ED, Gu R, Pierce C, Kil J. Reduction of acute cisplatin ototoxicity and nephrotoxicity in rats by oral administration of allopurinol and ebselen. Hear Res 2005;201(1-2):81-9.
57. Mukherjea D, Jajoo S, Sheehan K, Kaur T, Sheth S, Bunch J, et al. NOX3 NADPH oxidase couples transient receptor potential vanilloid 1 to signal transducer and activator of transcription 1-mediated inflammation and hearing loss. Antioxid Redox Signal 2011;14(6):999-1010.
58. Laurell G, Ekborn A, Viberg A, Canlon B. Effects of a single high dose of cisplatin on the melanocytes of the stria vascularis in the guinea pig. Audiol Neurootol 2007;12(3):170-8.
60. Poirrier AL, Pincemail J, Van Den Ackerveken P, Lefebvre PP, Malgrange B. Oxidative stress in the cochlea: An update. Curr Med Chem 2010;17(30):3591-604.
61. Rybak LP, Mukherjea D, Ramkumar V. Mechanisms of cisplatininduced ototoxicity and prevention. Semin Hear 2019;40(2):197-204.
62. Mukherjea D, Jajoo S, Kaur T, Sheehan KE, Ramkumar V, Rybak LP. Transtympanic administration of short interfering (si)RNA for the NOX3 isoform of NADPH oxidase protects against cisplatin-induced hearing loss in the rat. Antioxid Redox Signal 2010;13(5):589-98.
63. Kim HJ, Lee JH, Kim SJ, Oh GS, Moon HD, Kwon KB, et al. Roles of NADPH oxidases in cisplatin-induced reactive oxygen species generation and ototoxicity. J Neurosci 2010;30(11):3933-46.
64. Mukherjea D, Jajoo S, Whitworth C, Bunch JR, Turner JG, Rybak LP, et al. Short interfering RNA against transient receptor potential vanilloid 1 attenuates cisplatin-induced hearing loss in the rat. J Neurosci 2008;28(49):13056-65.
65. Sheth S, Mukherjea D, Rybak LP, Ramkumar V. Mechanisms of cisplatin-induced ototoxicity and otoprotection. Front Cell Neurosci 2017;11:338.
66. Teitz T, Fang J, Goktug AN, Bonga JD, Diao S, Hazlitt RA, et al. CDK2 inhibitors as candidate therapeutics for cisplatin- and noise-induced hearing loss. J Exp Med 2018;215(4):1187-203.
67. Previati M, Lanzoni I, Astolfi L, Fagioli F, Vecchiati G, Pagnoni A, et al. Cisplatin cytotoxicity in organ of Corti-derived immortalized cells. J Cell Biochem 2007;101(5):1185-97.
68. Van Houten B, Santa-Gonzalez GA, Camargo M. DNA repair after oxidative stress: Current challenges. Curr Opin Toxicol 2018;7:9-16.
69. Kim HJ, Oh GS, Shen A, Lee SB, Choe SK, Kwon KB, et al. Augmentation of NAD(+) by NQO1 attenuates cisplatin-mediated hearing impairment. Cell Death Dis 2014;5(6):e1292.
70. Jamesdaniel S, Coling D, Hinduja S, Ding D, Li J, Cassidy L, et al. Cisplatin-induced ototoxicity is mediated by nitroxidative modification of cochlear proteins characterized by nitration of Lmo4. J Biol Chem 2012;287(22):18674-86.
71. Jamesdaniel S, Rathinam R, Neumann WL. Targeting nitrative stress for attenuating cisplatin-induced downregulation of cochlear LIM domain only 4 and ototoxicity. Redox Biol 2016;10:257-65.
72. Rathinam R, Ghosh S, Neumann WL, Jamesdaniel S. Cisplatininduced apoptosis in auditory, renal, and neuronal cells is associated with nitration and downregulation of LMO4. Cell Death Discov 2015;1:15052.
73. Li Y, Li A, Wu J, He Y, Yu H, Chai R, et al. MiR-182-5p protects inner ear hair cells from cisplatin-induced apoptosis by inhibiting FOXO3a. Cell Death Dis 2016;7(9):e2362.
74. Devarajan P, Savoca M, Castaneda MP, Park MS, Esteban-Cruciani N, Kalinec G, et al. Cisplatin-induced apoptosis in auditory cells: Role of death receptor and mitochondrial pathways. Hear Res 2002;174(1-2):45-54.
75. Alam SA, Ikeda K, Oshima T, Suzuki M, Kawase T, Kikuchi T, et al. Cisplatin-induced apoptotic cell death in Mongolian gerbil cochlea. Hear Res 2000;141(1-2):28-38.
76. Lee JS, Kang SU, Hwang HS, Pyun JH, Choung YH, Kim CH. Epicatechin protects the auditory organ by attenuating cisplatininduced ototoxicity through inhibition of ERK. Toxicol Lett 2010;199(3):308-16.
77. Orz├Īez M, Sancho M, March├Īn S, Mondrag├│n L, Montava R, Valero JG, et al. Apaf-1 inhibitors protect from unwanted cell death in in vivo models of kidney ischemia and chemotherapy induced ototoxicity. PLoS One 2014;9(10):e110979.
78. Zhang M, Liu W, Ding D, Salvi R. Pifithrin-alpha suppresses p53 and protects cochlear and vestibular hair cells from cisplatininduced apoptosis. Neuroscience 2003;120(1):191-205.
79. Fernandes-Alnemri T, Wu J, Yu JW, Datta P, Miller B, Jankowski W, et al. The pyroptosome: A supramolecular assembly of ASC dimers mediating inf lammatory cell death via caspase-1 activation. Cell Death Differ 2007;14(9):1590-604.
80. Pang J, Xiong H, Zhan T, Cheng G, Jia H, Ye Y, et al. Sirtuin 1 and autophagy attenuate cisplatin-induced hair cell death in the mouse cochlea and zebrafish lateral line. Front Cell Neurosci 2019;12:515.
81. Xu FL, Cheng Y, Yan W. Up-regulation of autophagy and apoptosis of cochlear hair cells in mouse models for deafness. Arch Med Sci 2018;17(2):535-41.
82. Yin H, Yang Q, Cao Z, Li H, Yu Z, Zhang G, et al. Activation of NLRX1-mediated autophagy accelerates the ototoxic potential of cisplatin in auditory cells. Toxicol Appl Pharmacol 2018;343:16-28.
83. Choi MJ, Kang H, Lee YY, Choo OS, Jang JH, Park SH, et al. Cisplatin-induced ototoxicity in rats is driven by RIP3-dependent necroptosis. Cells 2019;8(5):409.
84. Wegner KW, Saleh D, Degterev A. Complex pathologic roles of RIPK1 and RIPK3: Moving beyond necroptosis. Trends Pharmacol Sci 2017;38(3):202-25.
85. Ruhl D, Du TT, Wagner EL, Choi JH, Li S, Reed R, et al. Necroptosis and apoptosis contribute to cisplatin and aminoglycoside ototoxicity. J Neurosci 2019;39(15):2951-64.
86. Lautermann J, Crann SA, McLaren J, Schacht J. Glutathionedependent antioxidant systems in the mammalian inner ear: Effects of aging, ototoxic drugs and noise. Hear Res 1997;114(1-2):75-82.
87. Neuwelt EA, Brummett RE, Remsen LG, Kroll RA, Pagel MA, McCormick CI, et al. In vitro and animal studies of sodium thiosulfate as a potential chemoprotectant against carboplatininduced ototoxicity. Cancer Res 1996;56(4):706-9.
88. Oh GS, Kim HJ, Choi JH, Shen A, Kim CH, Kim SJ, et al. Activation of lipopolysaccharide-TLR4 signaling accelerates the ototoxic potential of cisplatin in mice. J Immunol 2011;186(2):1140-50.
89. Oblak A, Jerala R. Toll-like receptor 4 activation in cancer progression and therapy. Clin Dev Immunol 2011;2011:609579.
90. Paulos CM, Wrzesinski C, Kaiser A, Hinrichs CS, Chieppa M, Cassard L, et al. Microbial translocation augments the function of adoptively transferred self/tumor-specific CD8+ T cells via TLR4 signaling. J Clin Invest 2007;117(8):2197-204.
91. Ross CJ, Katzov-Eckert H, Dub├® MP, Brooks B, Rassekh SR, Barhdadi A, et al. Genetic variants in TPMT and COMT are associated with hearing loss in children receiving cisplatin chemotherapy. Nat Genet 2009;41(12):1345-9.
92. Xu H, Robinson GW, Huang J, Lim JY, Zhang H, Bass JK, et al. Common variants in ACYP2 influence susceptibility to cisplatininduced hearing loss. Nat Genet 2015;47(3):263-6.
93. Tserga E, Nandwani T, Edvall NK, Bulla J, Patel P, Canlon B, et al. The genetic vulnerability to cisplatin ototoxicity: A systematic review. Sci Rep 2019;9(1):3455.
94. Bokemeyer C, Berger CC, Hartmann JT, Kollmannsberger C, Schmoll HJ, Kuczyk MA, et al. Analysis of risk factors for cisplatin-induced ototoxicity in patients with testicular cancer. Br J Cancer 1998;77(8):1355-62.
95. Kim KH, Lee B, Kim YR, Kim MA, Ryu N, Jung DJ, et al. Evaluating protective and therapeutic effects of alpha-lipoic acid on cisplatin-induced ototoxicity. Cell Death Dis 2018;9(8):827.
96. Kalcioglu MT, Kizilay A, Gulec M, Karatas E, Iraz M, Akyol O, et al. The protective effect of erdosteine against ototoxicity induced by cisplatin in rats. Eur Arch Otorhinolaryngol 2005;262(10):856-63.
97. Bhatta P, Dhukhwa A, Sheehan K, Al Aameri RFH, Borse V, Ghosh S, et al. Capsaicin protects against cisplatin ototoxicity by changing the STAT3/STAT1 ratio and activating cannabinoid (CB2) receptors in the cochlea. Sci Rep 2019;9:4131.
98. Paciello F, Fetoni AR, Mezzogori D, Rolesi R, Di Pino A, Paludetti G, et al. The dual role of curcumin and ferulic acid in counteracting chemoresistance and cisplatin-induced ototoxicity. Sci Rep 2020;10(1):1063.
99. Borse V, Al Aameri RFH, Sheehan K, Sheth S, Kaur T, Mukherjea D, et al. Epigallocatechin-3-gallate, a prototypic chemopreventative agent for protection against cisplatin-based ototoxicity. Cell Death Dis 2017;8:e2921.
100. Campbell KC, Rybak LP, Meech RP, Hughes L. D-methionine provides excellent protection from cisplatin ototoxicity in the rat. Hear Res 1996;102(1-2):90-8.
101. Kalkanis JG, Whitworth C, Rybak LP. Vitamin E reduces cisplatin ototoxicity. Laryngoscope 2004;114(3):538-42.
102. Fernandez K, Spielbauer KK, Rusheen A, Wang L, Baker TG, Eyles S, et al. Lovastatin protects against cisplatin-induced hearing loss in mice. Hear Res 2020;389:107905.
103. Benkafadar N, Menardo J, Bourien J, Nouvian R, Fran├¦ois F, Decaudin D, et al. Reversible p53 inhibition prevents cisplatin ototoxicity without blocking chemotherapeutic efficacy. EMBO Mol Med 2017;9(1):7-26.
104. Sun C, Wang X, Chen D, Lin X, Yu D, Wu H. Dexamethasone loaded nanoparticles exert protective effects against cisplatininduced hearing loss by systemic administration. Neurosci Lett 2016;619:142-8.
105. Bhatta P, Dhukhwa A, Sheehan K, Al Aameri RFH, Borse V, Ghosh S, et al. Capsaicin protects against cisplatin ototoxicity by changing the STAT3/STAT1 ratio and activating cannabinoid (CB2) receptors in the cochlea. Sci Rep 2019;9(1):4131.
106. Shafik AG, Elkabarity RH, Thabet MT, Soliman NB, Kalleny NK. Effect of intratympanic dexamethasone administration on cisplatin-induced ototoxicity in adult guinea pigs. Auris Nasus Larynx 2013;40(1):51-60.
107. Li G, Frenz DA, Brahmblatt S, Feghali JG, Ruben RJ, Berggren D, et al. Round window membrane delivery of L-methionine provides protection from cisplatin ototoxicity without compromising chemotherapeutic efficacy. Neurotoxicology 2001;22(2):163-76.
108. Wang J, Lloyd Faulconbridge RV, Fetoni A, Guitton MJ, Pujol R, Puel JL. Local application of sodium thiosulfate prevents cisplatininduced hearing loss in the guinea pig. Neuropharmacology 2003;45(3):380-93.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 |
 |