 |
 |
AbstractDizziness is one of the most common symptoms in the elderly. Various vestibular disorders, such as benign paroxysmal positional vertigo, vestibular neuritis, MeniereŌĆÖs disease, vestibular migraine, can cause dizziness. The vestibular system consists of the peripheral vestibular organs in the inner ear and the extensive central nervous system from the cerebellum and brainstem to the thalamus to cortex. In particularly, vestibular sensory input plays a important role in spatial cognitive abilities such as spatial memory and spatial navigation. In the elderly, cognitive decline, such as mild cognitive impairment, AlzheimerŌĆÖs disease and other dementia, is a very frightening disease that worsens the quality of life. It is possible to evaluate vestibular dysfunction through vestibular function test, and there are various evaluation methods for cognitive function. The evidence has been gradually accumulating to suggest that the balance organs or ŌĆśvestibular system,ŌĆÖ might also be important in the development of cognitive dysfunction and dementia. Animal studies, pathologic and imaging evidence, and behavioral assays on the relationship between various diseases related to dizziness and cognitive dysfunction are supporting that. Given that vestibular dysfunction can be treated through physical-therapy such as vestibular rehabilitation, identifying and treating dizziness in older adults with and without cognitive impairment may provide potential benefits in preventing, mitigating cognitive decline.
ņä£ ļĪĀĻĘ╝ļלņŚÉ ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņÖĆ ņ╣śļ¦żņØś ņ£äĒŚśņÜöņØĖņ£╝ļĪ£ Ēü░ ņŻ╝ļ¬®ņØä ļ░øĻ│Ā ņ׳ņ£╝ļ®░ ņĀüĻĘ╣ņĀüņØĖ ņ▓ŁĻ░üņ×¼ĒÖ£ņØś ĒĢäņÜöņä▒ņØ┤ Ļ░ĢņĪ░ļÉśĻ│Ā ņ׳ļŗż[1]. ļé£ņ▓ŁĻ│╝ ĒĢ©Ļ╗ś ņ¢┤ņ¦Ćļ¤╝ņØĆ ņØ┤Ļ│╝ņĀüņØĖ ļīĆĒæ£ņĀü ņ”ØņāüņØś ĒĢśļéśļĪ£ ņéČņØś ņ¦łņØä ļ¢©ņ¢┤ļ£©ļ”¼ļŖö ĒØöĒĢ£ ņ”ØņāüņØ┤ļŗż[2]. ļśÉĒĢ£ ņ¢┤ņ¦Ćļ¤╝ņØĆ Ļ│ĀļĀ╣ņØś ņØĖĻĄ¼ņŚÉņä£ ļŹö ļ╣łļ▓łĒĢ£ ņ”Øņāüņ£╝ļĪ£, ļģĖĒÖöņŚÉ ļö░ļźĖ ņ×ÉņŚ░ņŖżļ¤¼ņÜ┤ ĒĢśļéśņØś ņ”Øņāüņ£╝ļĪ£ Ļ░äĻ│╝ļÉśĻĖ░ ņēĮļŗż[3]. ĒĢśņ¦Ćļ¦ī ņ¢┤ņ¦Ćļ¤╝ņŚÉ ļīĆĒĢ£ Ļ▓Ćņé¼ņÖĆ ņ╣śļŻīļ▓ĢņØ┤ ņåīĻ░£ļÉśļ®┤ņä£ ņŚ░ĻĄ¼ņ×Éļ┐Éļ¦ī ņĢäļŗłļØ╝ ĒÖśņ×ÉņØś ņÜöĻĄ¼ņÖĆ Ļ┤Ćņŗ¼ļÅä ļåÆņĢäņ¦ĆĻ│Ā ņ׳ļŗż. ļśÉĒĢ£ ņé¼ļ×īļōżņØś ņłśļ¬ģņØ┤ ļŖśņ¢┤ļéśļ®┤ņä£ Ļ▒┤Ļ░ĢĒĢ£ Ļ│ĀļĀ╣ņØś ņéČņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ļÅä ļåÆņĢäņ¦ĆĻ│Ā ņ׳ļŗż. ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņÖĆ ņ╣śļ¦żļŖö Ļ│ĀļĀ╣ņØś Ļ▒┤Ļ░ĢĻ│╝ ņéČņØś ņ¦łĻ│╝ Ļ┤ĆļĀ©ļÉ£ ļ¦żņÜ░ ņżæņÜöĒĢ£ ņ¦łĒÖśņ£╝ļĪ£ ņØ┤ņŚÉ ļīĆĒĢ£ ņé¼ļ×īļōżņØś ļæÉļĀżņøĆņØ┤ ļ¦żņÜ░ Ēü░ ĒÄĖņØ┤ļŗż[4].
ĒĢ£ĒÄĖ, ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦żņØś ņŚ░Ļ┤Ćņä▒ņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ņÖĆ ļŗ¼ļ”¼ ņ¢┤ņ¦Ćļ¤╝Ļ│╝ ņØĖņ¦ĆĻĖ░ļŖźĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņŚÉ ļīĆĒĢ┤ņä£ļŖö ņāüļīĆņĀüņ£╝ļĪ£ ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖĻ│Ā, ņŗżņĀ£ ņ¢┤ņ¦Ćļ¤╝ņØ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņÖĆ ņ╣śļ¦żņØś ļ░£ļ│æņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖöņ¦Ć ļģ╝ļ×ĆņØ┤ ņ׳ļŗż[5].
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ¢┤ņ¦Ćļ¤╝ņØä ņ£Āļ░£ĒĢśļŖö ņ¦łĒÖśļōżĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś ņŚ░Ļ┤Ćņä▒ņŚÉ ļīĆĒĢ£ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżņØä ņĀĢļ”¼ĒĢśĻ│Ā, ņØĖņ¦ĆĻĖ░ļŖźĻ│╝ ņ¢┤ņ¦Ćļ¤╝ ņ¦łĒÖśņŚÉ Ļ┤ĆĒĢ£ Ē¢źĒøä ņŚ░ĻĄ¼ ļ░®Ē¢źĻ│╝ ņ╣śļŻīņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ļ│Ė ļĪĀņ¢┤ņ¦Ćļ¤╝ņØĆ ņØ┤ļ╣äņØĖĒøäĻ│╝ Ēü┤ļ”¼ļŗēņŚÉ Ļ░Ćņן ļ¦ÄņØĆ ĒÖśņ×ÉļōżņØ┤ ļé┤ņøÉĒĢśļŖö ņøÉņØĖ ņżæ ĒĢśļéśņØ┤ļŗż. ņ¢┤ņ¦Ćļ¤╝Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ļ¬©ļōĀ ņøÉņØĖņØ┤ ņĀäņĀĢĻ│äņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ▓āņØĆ ņĢäļŗłņ¦Ćļ¦ī ņĢĮ 20%-50%ļŖö ļ¦Éņ┤łņĀäņĀĢĻ│äņÖĆ Ļ┤ĆļĀ©ļÉ£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀļĪ£ ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[6]. ņĀäņĀĢĻĖ░ļŖźņןņĢĀļŖö ņ¢æņä▒ļÅīļ░£ļæÉņ£äĒśäĒøł, ņĀäņĀĢņŗĀĻ▓ĮņŚ╝, ļ®öļŗłņŚÉļź┤ļ│æ, ļ»ĖļĪ£ņŚ╝, ņØ┤Ļ▓ĮĒÖöņ”Ø, ĒÄĖļæÉĒåĄņØ┤ļéś ņÖĖņāüņä▒ ļćīņåÉņāüņŚÉ ņØśĒĢ£ ņןņĢĀ ļō▒ņØä ĒżĒĢ©ĒĢ£ļŗż. ļ»ĖĻĄŁņØś ĒĢ£ ĒåĄĻ│äņŚÉ ņØśĒĢśļ®┤ 40ņäĖ ņØ┤ņāüņØś ņä▒ņØĖ ņĢĮ 35.4%ņŚÉņä£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳Ļ│Ā, ņŚ░ļĀ╣ņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņĀäņĀĢĻĖ░ļŖźņןņĢĀņØś ņ£Āļ│æļźĀņØ┤ ņ”ØĻ░ĆĒĢśļ®░, ņĀäņĀĢĻĖ░ļŖźņןņĢĀ ĒÖśņ×ÉņŚÉņä£ ļéÖņāü ņ£äĒŚśņØ┤ ņĀĢņāüņØĖņŚÉ ļ╣äĒĢ┤ 12ļ░░ ņØ┤ņāü ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[7].
ņĀäņĀĢĻ│äņÖĆ ņżæņČöņŗĀĻ▓ĮĻ│äņØś ņ×æņÜ®ņĀäņĀĢĻ│äļŖö ļŗżņ¢æĒĢ£ ĒÅēļ®┤ņŚÉņä£ņØś ļ©Ėļ”¼ ņøĆņ¦üņ×äĻ│╝ ņżæļĀźņŚÉ ļīĆĒĢ£ ņłśņ¦üņÜ┤ļÅÖņØä Ļ░Éņ¦ĆĒĢśĻ│Ā, ņĀäņĀĢņĢłļ░śņé¼ļź╝ ĒåĄĒĢ┤ ļ©Ėļ”¼ņØś ņøĆņ¦üņ×äņØä ļ│┤ņāüĒĢśļŖö ĻĖēņåŹņĢłĻĄ¼ņÜ┤ļÅÖņØä ņ£Āļ░£ĒĢśņŚ¼ ļ¦Øļ¦ēņŚÉņä£ ņŗ£Ļ░üņĀü ņØ┤ļ»Ėņ¦ĆņØś ņĢłņĀĢņä▒ņØä ņ£Āņ¦ĆĒĢśļ®░, ņĀäņĀĢņ▓Öņłśļ░śņé¼ļź╝ ĒåĄĒĢ┤ ņ×ÉņäĖļź╝ ņĪ░ņĀĢĒĢśņŚ¼ ņŗĀņ▓┤ļŖö ĒÅēĒśĢņØä ņ£Āņ¦ĆĒĢĀ ņłś ņ׳ļŗż[8]. ļö░ļØ╝ņä£ ņĀäņĀĢĻ│äĻ░Ć ņĀĢņāüņØ┤ ņĢäļŗłļ®┤ ņŗ£Ļ░üņØĆ ĒØÉļĀżņ¦ĆĻ│Ā ĒÅēĒśĢĻ│╝ ņÜ┤ļÅÖņŚÉ ņ¦ĆņןņØä ļ░øļŖöļŗż.
ļ©Ėļ”¼ņØś ņøĆņ¦üņ×äņŚÉ ļīĆĒĢ£ ņĀĢļ│┤ļŖö ĒĢ┤ļ¦ł(hippocampus)ņÖĆ Ļ░ÖņØĆ ļćīņØś ņāüņ£ä ņżæņČöļĪ£ ņĀäļŗ¼ļÉśņ¢┤ ĒÖśĻ▓ĮņŚÉ ļīĆĒĢ£ ņØśņŗØņĀü Ļ▓ĮĒŚśĻ│╝ ĻĖ░ņ¢ĄĻ│╝ Ļ░ÖņØĆ ņØĖņ¦Ć Ļ│╝ņĀĢņŚÉ ĻĖ░ņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[9]. ļ╣äļĪØ ņĀäņĀĢ ņĀĢļ│┤Ļ░Ć ĒĢ┤ļ¦łņÖĆ Ļ░ÖņØĆ ļćīņØś ņśüņŚŁņŚÉ ļÅäļŗ¼ĒĢśļŖö ĻĄ¼ņ▓┤ņĀüņØĖ Ļ▓ĮļĪ£Ļ░Ć ņĢäņ¦ü ņÖäņĀäĒ׳ ņäżļ¬ģļÉśņ¦ĆļŖö ņĢŖņĢśņ¦Ćļ¦ī, ņĀäņĀĢĒĢĄĻ│╝ ņåīļćīņØś ņŗĀĒśĖļŖö ņŚ¼ļ¤¼ Ļ▓ĮļĪ£, ĒŖ╣Ē׳ ņŗ£ņāü(thalamus)ņØä ĒåĄĒĢ┤ ņĀĢļ│┤ļź╝ ņĀäļŗ¼ĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż(Fig. 1) [10]. ļśÉĒĢ£ ņØ┤ ņĀĢļ│┤ļŖö ņŗ£Ļ░ü, ņ▓ŁĻ░ü, ņ┤ēĻ░ü, ĒøäĻ░ü ļ░Å Ļ│Āņ£Ā Ļ░ÉĻ░ü ņŗ£ņŖżĒģ£ņØś ņĀĢļ│┤ņÖĆ Ļ░ÖņØ┤ ļŗżļźĖ Ļ░ÉĻ░ü ņĀĢļ│┤ņÖĆ ĒåĄĒĢ®ļÉśņ¢┤ Ļ│ĄĻ░äņŚÉ ļīĆĒĢ£ ņ¦ĆļÅäņÖĆ Ļ░ÖņØ┤ ĻĖ░ņ¢ĄļÉśņ¢┤ ņØ┤Ēøä ņĀĢļ│┤ļź╝ ļŹöņÜ▒ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņ░ŠņØä ņłś ņ׳ļÅäļĪØ ļÅäņÖĆņżĆļŗż[11]. ņØ┤ļ¤░ ņØ┤ņ£ĀļĪ£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀņÖĆ ĒÅēĒśĢņןņĢĀ ļ░Å ļéÖņāüĻ│╝ņØś Ļ┤ĆļĀ©ņä▒ņØĆ ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ļćīĻ░äņĀäņĀĢļ░śņé¼ Ļ▓ĮļĪ£ņŚÉ ļīĆĒĢ┤ ļ»Ėņ╣śļŖö ņśüĒ¢ź ņÖĖņŚÉļÅä ņĀäņĀĢĻ│äļĪ£ļČĆĒä░ ņśżļŖö ņøĆņ¦üņ×ä ņŗĀĒśĖņŚÉ ļīĆĒĢ┤ ļåÆņØĆ ņØĖņ¦Ćņ▓śļ”¼ ļŖźļĀźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢ź ļĢīļ¼ĖņØ┤ļØ╝ļŖö Ļ░ĆņäżņØ┤ ņĀ£ņŗ£ļÉśĻ│Ā ņ׳ļŗż.
ĒĢ┤ļ¦łņŚÉņä£ ņŻ╝ļ│Ć ĒÖśĻ▓ĮņØś ĒŖ╣ņĀĢ ņśüņŚŁņŚÉ ļ░śņØæĒĢśļŖö ļē┤ļ¤░ņØĖ ņןņåī ņäĖĒż(place cells)ņÖĆ ņŻ╝ļ│Ć ĒÖśĻ▓ĮņØś ņŚ¼ļ¤¼ ņśüņŚŁņŚÉ ļ░śņØæĒĢśļŖö ļé┤ĒøäĻ░üĒö╝ņ¦ł(medial entorhinal cortex)ņØś Ļ▓®ņ×ÉņäĖĒż(grid cells) ļō▒ņØś ļē┤ļ¤░ļōżņØ┤ ļé┤ņØ┤ļĪ£ļČĆĒä░ ņśżļŖö ņĀäņĀĢ ņĀĢļ│┤ņŚÉ ņØśņĪ┤ĒĢśņŚ¼ ņ×ÉņŗĀņØś ņ£äņ╣ś ņĀĢļ│┤ļź╝ ĒāÉņāēĒĢśļŖö ļŹ░ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[12]. ļśÉĒĢ£ ņØ┤ņäØņØ┤ ļ░śĻ│Āļ”¼Ļ┤ĆĻ│╝ ļÅģļ”ĮņĀüņ£╝ļĪ£ ņØĖņ¦Ćņ▓śļ”¼ Ļ│╝ņĀĢņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśĻ│Ā, ņĀäņĀĢĻ│äņØś ņĀĢļ│┤Ļ░Ć ņżæņČöņŗĀĻ▓ĮĻ│äļ┐Éļ¦ī ņĢäļŗłļØ╝ Ļ│ĀļÅäņØś ņØĖņ¦ĆĻĖ░ļŖźņŚÉ Ļ┤ĆņŚ¼ĒĢ£ļŗżļŖö ĻĘ╝Ļ▒░Ļ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż[13]. ņØ┤ļŖö ņĀäņĀĢņĢłļ░śņé¼ņÖĆ ņĀäņĀĢņ▓Öņłśļ░śņé¼ņØś ļ¼ĖņĀ£ņÖĆ Ļ░ÖņØĆ ņĀäņĀĢĻĖ░ļŖźņØś ņןņĢĀļ┐Éļ¦ī ņĢäļŗłļØ╝ Ļ│ĄĻ░äņŚÉ ļīĆĒĢ£ ņĀĢļ│┤ņÖĆ ĻĖ░ņ¢ĄņØä ĒåĄĒĢ┤ ņ£äņ╣śļź╝ ĒāÉņāēĒĢśĻ▒░ļéś ļ©Ėļ”¼ņØś ņøĆņ¦üņ×äņŚÉ ļīĆĒĢ£ ņĀĢļ│┤ļź╝ ĒåĄĒĢ®ĒĢśļŖö ļćīņØś ņןņĢĀ ļśÉĒĢ£ ļéÖņāüņØä ņ£Āļ░£ĒĢśļŖö ņ¢┤ņ¦Ćļ¤╝Ļ│╝ ņŚ░Ļ┤ĆņØ┤ ņ׳ņØä ņłś ņ׳ļŗżļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż.
ņØĖņ¦Ć-ņĀäņĀĢ Ļ┤ĆĻ│äļź╝ ļÆĘļ░øņ╣©ĒĢśļŖö ņØ┤ļĪĀņĀü ļ░░Ļ▓ĮņĀäņĀĢĻĖ░ļŖźņןņĢĀņÖĆ ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀ ņé¼ņØ┤ņØś Ļ┤ĆĻ│äļź╝ ņäżļ¬ģĒĢśļŖö ļæÉ Ļ░Ćņ¦Ć ņĀĆļ¬ģĒĢ£ ņØ┤ļĪĀņØ┤ ņĪ┤ņ×¼ĒĢ£ļŗż[14]. ņ▓½ ļ▓łņ¦ĖļŖö ņØĖņ¦ĆņÖĆ ņĀäņĀĢ ņé¼ņØ┤Ļ░Ć Ļ░äņĀæņĀüņ£╝ļĪ£ ņŚ░Ļ▓░ļÉśņ¢┤ ņ׳ļŗżļŖö Ļ░ĆņĀĢņ£╝ļĪ£, ņĀĢņŗĀņĀü ņ×æņŚģĻ│╝ ĒÅēĒśĢ ņ×æņŚģņŚÉ ļÅÖņŗ£ņŚÉ ĒĢĀļŗ╣ĒĢĀ ņłś ņ׳ļŖö ņØĖņ¦Ć ņ×ÉņøÉņØ┤ ņĀ£ĒĢ£ļÉśņ¢┤ ņ׳ņ¢┤ ņĀäņĀĢĻĖ░ļŖźņןņĢĀļĪ£ ņØĖĒĢ┤ ĒÅēĒśĢ ņ×æņŚģņŚÉ ļŹö ļ¦ÄņØĆ ņØĖņ¦Ć ņ×ÉņøÉņØä ņé¼ņÜ®ĒĢśĻ▓ī ļÉśļ®┤ ņĀĢņŗĀņĀü ņ×æņŚģņØä ĒĢĀ ņłś ņ׳ļŖö ņØĖņ¦Ć ņ×ÉņøÉņŚÉ ņĀ£ĒĢ£ņØä ļ░øņØä ņłś ņ׳ļŗżļŖö Ļ▓āņØ┤ļŗż. ļæÉ ļ▓łņ¦ĖļŖö ņØĖņ¦ĆņÖĆ ņĀäņĀĢ ņé¼ņØ┤Ļ░Ć ņ¦üņĀæņĀüņ£╝ļĪ£ ņŚ░Ļ▓░ļÉśņ¢┤ ņ׳ļŗżļŖö Ļ░ĆņĀĢņ£╝ļĪ£, ļćīļŖö ņĀäņĀĢĻ│╝ ņØĖņ¦Ć ņŗĀĒśĖĻ░Ć ņä£ļĪ£ ņĀĢļ│┤ļź╝ ņŻ╝Ļ│Ā ļ░øņØä ņłś ņ׳ļÅäļĪØ ĒĢ┤ļČĆĒĢÖņĀüņ£╝ļĪ£ ļ░ĆņĀæĒĢśĻ▓ī ņ£äņ╣śĒĢśļÅäļĪØ ĻĄ¼ņĪ░ĒÖöļÉśņ¢┤ ņ׳ņ¢┤ ļćīņØś ņØĖņ¦ĆĻĖ░ļŖź ņśüņŚŁņŚÉ ļ│æļ│ĆņØ┤ ņ׳ņ¢┤ ņןņĢĀĻ░Ć ļ░£ņāØĒĢĀ Ļ▓ĮņÜ░ ĻĘĖ ņØĖņĀæ ļČĆņ£äņŚÉ ņĀäņĀĢĻĖ░ļŖź ņśüņŚŁņØ┤ ņĪ┤ņ×¼ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ļ│æļ│ĆņØ┤ ļÅÖņŗ£ņŚÉ ņ╣©ļ▓öļÉśņ¢┤ ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ļÅÖņŗ£ņŚÉ ļ░£ņāØĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ļåÆĻ│Ā ļ░śļīĆņØś Ļ▓ĮņÜ░ļÅä ļ¦łņ░¼Ļ░Ćņ¦ĆļØ╝ļŖö Ļ▓āņØ┤ļŗż.
ņĀäņĀĢĻĖ░ļŖźņןņĢĀņÖĆ ņØĖņ¦ĆĻĖ░ļŖźĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØ┤ņĀäņŚÉļŖö ņĀäņĀĢĻĖ░ļŖźņןņĢĀļŖö ĒÅēĒśĢĻ│╝ Ļ│ĄĻ░äņŚÉ ļ░®Ē¢ź Ļ░ÉĻ░üņŚÉļ¦ī ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśņŚłņ£╝ļéś ņĀäņĀĢĻĖ░ļŖźņןņĢĀņÖĆ ņØĖņ¦ĆļŖźļĀź Ļ▓░ĒĢŹĻ│╝ņØś ņŚ░Ļ┤Ć Ļ┤ĆĻ│äļź╝ ļÆĘļ░øņ╣©ĒĢśļŖö ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ļōżņØ┤ ļ¦ÄņĢäņ¦ĆĻ│Ā ņ׳ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņØĖņ¦ĆļŖźļĀź Ļ▓░ĒĢŹņØĆ ņĀĢļ│┤ņŚÉ ļīĆĒĢ£ ņĀĢņŗĀņĀü ņ▓śļ”¼ Ļ│╝ņĀĢņØś ņןņĢĀļź╝ ņØśļ»ĖĒĢ£ļŗż. ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀļŖö ņØ╝ņāü ĒÖ£ļÅÖņØä ņłśĒ¢ēĒĢśļŖö ļŖźļĀźņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śĻ│Ā, ņéČņØś ņ¦łņØä ļ¢©ņ¢┤ļ£©ļ”¼ļ®░, ņĀäņĀĢĻĖ░ļŖźņןņĢĀļŖö Ļ│ĄĻ░ä ņØĖņŗØ, ĻĖ░ņ¢Ą ļ░Å ņŻ╝ņØśļĀźĻ│╝ Ļ░ÖņØĆ ļ¦ÄņØĆ ņśüņŚŁņŚÉņä£ Ļ▓░ĒĢŹņØä ņ£Āļ░£ĒĢ£ļŗż[14].
ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀņÖĆ ņŚ░Ļ┤ĆļÉśļŖö ļ®öņ╗żļŗłņ”śņØĆ ņĢäņ¦ü ļČłļČäļ¬ģĒĢśņ¦Ćļ¦ī, ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ņŚÉ ņØśĒĢ┤ ņĀ£ņĢłļÉ£ Ļ░ĆņäżņØ┤ ņ׳ļŗż[15]. ĻĘĖ Ļ░ĆņäżņŚÉ ļö░ļź┤ļ®┤ ņĀäņĀĢĻĖ░ļŖźņןņĢĀļŖö ĒĢ┤ļ¦łļź╝ ĒżĒĢ©ĒĢśņŚ¼ ļīĆļćī Ēö╝ņ¦łņØś ņĀäņĀĢ ļäżĒŖĖņøīĒü¼ ļé┤ ņśüņŚŁņØś ņ£äņČĢņ£╝ļĪ£ ņØ┤ņ¢┤ņ¦ł ņłś ņ׳ņ£╝ļ®░, ņØ┤ļŖö ĻĖ░ņ¢ĄļĀź ļ░Å ņŗ£Ļ│ĄĻ░ä ļŖźļĀź ņןņĢĀņØś ņøÉņØĖņØ┤ ļÉĀ ņłś ņ׳ļŗż. ļśÉĒĢ£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀņÖĆ Ļ┤ĆļĀ©ļÉ£ ņŻ╝ņŗ£ ļ░Å ņ×ÉņäĖ ļČłņĢłņĀĢņä▒ņØĆ ĻĘĀĒśĢņØä ņ£Āņ¦ĆĒĢśĻĖ░ ņ£äĒĢ┤ ĒĢĀļŗ╣ļÉ£ ņŻ╝ņØśļĀźņØä ņČöĻ░ĆļĪ£ ĒĢäņÜöļĪ£ ĒĢśĻ▓ī ļÉśĻ│Ā, ņØĖņ¦Ć ņ×æņŚģņŚÉ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖö ļćīņØś ņÜ®ļ¤ēņØ┤ ņāüļīĆņĀüņ£╝ļĪ£ ņżäņ¢┤ļōż ņłś ņ׳ļŗż. ĻĘĖļ”¼Ļ│Ā ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ņ׳ļŖö ņé¼ļ×īņŚÉņä£ ļ¦ÄņØ┤ ļÅÖļ░śļÉśļŖö ņĀĢļÅÖņןņĢĀ ļśÉĒĢ£ ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀņØś ņøÉņØĖņØ┤ ļÉĀ ņłś ņ׳ļŗżĻ│Ā ļ│Ėļŗż.
ĒĢ£ĒÄĖ, ņØ┤ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņĀäņĀĢĻĖ░ļŖźņןņĢĀņŚÉ ņØ┤ņ░©ņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśļŖö ņØ╝ļ░śņĀüņØĖ ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀļŖö Ļ│ĄĻ░äņŚÉ ļīĆĒĢ£ ĻĖ░ņ¢ĄĻ│╝ ĒāÉņāēņØś ļ¼ĖņĀ£ņØ┤ļŗż[15]. ĻĘĖļ”¼Ļ│Ā ĻĖ░ņ¢ĄņØĆ ņĀäņĀĢĻĖ░ļŖźņןņĢĀņŚÉ ņØśĒĢ┤ ņśüĒ¢źņØä ļ░øļŖö ņØĖņ¦ĆņØś ĒĢ£ ņśüņŚŁņ£╝ļĪ£ņä£ ņŗ£Ļ░üĻĖ░ņ¢Ą ņןņĢĀļŖö ņĀäņĀĢĻĖ░ļŖźņןņĢĀ ĒÖśņ×ÉņŚÉņä£ ĒØöĒĢ£ ņ”Øņāü ņżæ ĒĢśļéśņØ┤ļŗż. ņŗ£Ļ░üņĀü ĻĖ░ņ¢ĄņØä ņÜöĻĄ¼ĒĢśļŖö ņł½ņ×ÉņØĖņ¦Ć Ļ▓Ćņé¼ņŚÉņä£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀ ĒÖśņ×ÉņŚÉņä£ ļŗ©ĻĖ░ ĻĖ░ņ¢ĄļĀźņØĆ ņĀĆĒĢśļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░, ņŻ╝ņØśļĀźņØś ņ▓ÖļÅäņØĖ ļ░śņØæ ņŗ£Ļ░äĻ│╝ ņŗżĒ¢ē ĻĖ░ļŖź ļśÉĒĢ£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ņ׳ļŖö ņé¼ļ×īņŚÉņä£ ņĀĆĒĢśļÉ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļéś ņĀäņĀĢĻĖ░ļŖźņןņĢĀļŖö ņŻ╝ņØśļĀźņŚÉļÅä ļČĆņĀĢņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņĀäņĀĢĻĖ░ļŖźņןņĢĀļŖö ņĀĢņāüņØĖļ┐Éļ¦ī ņĢäļŗłļØ╝ ņŻ╝ņØśļĀźĻ▓░ĒĢŹ Ļ│╝ņ×ēĒ¢ēļÅÖņןņĢĀ(attention-deficit/hyperactivity disorder) ņĢäļÅÖņŚÉĻ▓īļÅä ņĢģņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[16].
ņØĖņ¦ĆĻĖ░ļŖźņŚÉņä£ ņĀäņĀĢĻ│äņØś ņŚŁĒĢĀņØä ļÆĘļ░øņ╣©ĒĢśļŖö ļÅÖļ¼╝ ņŚ░ĻĄ¼ļÅÖļ¼╝ņØś ļ»ĖļĪ£ņŚÉņä£ ļ©╣ņØ┤ņ░ŠĻĖ░ ņ×æņŚģ ņŚ░ĻĄ¼ņŚÉņä£ ļ¦Éņ┤łņĀäņĀĢĻ│äņØś ņØ╝ņĖĪ ļśÉļŖö ņ¢æņĖĪ ļ│æļ│ĆņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ Ļ│ĄĻ░äņŚÉ ļīĆĒĢ£ ĻĖ░ņ¢ĄņØ┤ ņåÉņāüļÉśņ¢┤ ņ׳ļŗżļŖö Ļ▓░Ļ│╝Ļ░Ć ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[17-19]. ņśłļź╝ļōżļ®┤ ņ¢æņĖĪņä▒ ņĀäņĀĢ ļ│æļ│ĆņØĆ ņŻ╝ļ│Ć ĒÖśĻ▓ĮņØś ņןņåīļź╝ ņĢöĒśĖĒÖöĒĢśļŖö ĒĢ┤ļ¦łņØś ļē┤ļ¤░ ĻĖ░ļŖźņØĖ ņןņåīņäĖĒżņØś ĻĖ░ļŖźņØä ņĪ░ņĀłĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉśļŖö ņäĖĒāĆ(theta) ņŻ╝Ēīīņłś ļ▓öņ£äņØś ļćīĒīī ĒÖ£ņä▒ņØä ņĀĆĒĢśņŗ£ĒéżĻ│Ā, ļé┤ĒøäĻ░üĒö╝ņ¦łņØś Ļ▓®ņ×É ņäĖĒż ņé¼ņØ┤ņØś ņäĖĒāĆĒīīļź╝ ņåÉņāüņŗ£ņ╝£ Ļ│ĄĻ░äņØĖņ¦ĆĻĖ░ļŖźņŚÉ ļ¼ĖņĀ£ļź╝ ņØ╝ņ£╝ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[12,20-23]. ļśÉĒĢ£ Ļ▓®ņ×ÉņäĖĒżņÖĆ ņןņåīņäĖĒżņØś ļ¼ĖņĀ£ ņ×Éņ▓┤Ļ░Ć ļÅÖļ¼╝ņŗżĒŚśņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö Ļ│ĄĻ░ä ĻĖ░ņ¢ĄļĀź ņןņĢĀņØś ņøÉņØĖņØ╝ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ļŗż[9,19].
ņØĖĻ░äņØś ņØĖņ¦Ć ņĀĆĒĢśņÖĆ ņĀäņĀĢĻĖ░ļŖźņןņĢĀņØś ņŚ░Ļ┤Ćņä▒ļÅÖļ¼╝ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ņä▒ņØĖņØś ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀņÖĆ Ļ┤ĆļĀ©ņ׳ļŗżļŖö ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļōżņØ┤ ņ׳ļŗż. ņØĖĻ░äņŚÉ ļīĆĒĢ£ Ē¢ēļÅÖ ļČäņäØĻ│╝ ĒĢ©Ļ╗ś ņŗ£Ē¢ēĒĢ£ ĻĄ¼ņĪ░ņĀü ļ░Å ĻĖ░ļŖźņĀü ņŗĀĻ▓Į ņśüņāü ņŚ░ĻĄ¼ņŚÉņä£ ņĀäņĀĢĻĖ░ļŖźņØś ņĀĆĒĢśĻ░Ć ĒĢ┤ļ¦łņØś ļČĆĒö╝ Ļ░ÉņåīņÖĆ ļ░ĆņĀæĒĢ£ Ļ┤ĆļĀ©ņØ┤ ņ׳ņŚłļŗż[24].
ņĀäņĀĢĻ│äļŖö ļģĖĒÖöņŚÉ ļö░ļØ╝ ļ░śĻ│Āļ”¼Ļ┤ĆĻ│╝ ņØ┤ņäØ ĻĖ░Ļ┤ĆņØś ņ£Āļ¬©ņäĖĒżņØś Ļ░Éņåī, ņĀäņĀĢ ņŗĀĻ▓ĮĻ│╝ ļćīĻ░ä ņĀäņĀĢĒĢĄņØś Ļ░Éņåī, ņĀäņĀĢļ░śņé¼ņØś ņĀĆĒĢś ļō▒ Ēć┤Ē¢ēĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[3]. ĒĢ£ĒÄĖ, ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ļģĖĒÖöņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØĖņ¦Ć ņĀĆĒĢśņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżļŖö ĻĘ╝Ļ▒░ļÅä ņĀ£ņŗ£ļÉśņŚłļŗż. ļéśņØ┤Ļ░Ć ņ¢æņĖĪ ĒĢ┤ļ¦łņÖĆ ņóīņĖĪ ĒøäĻ░üĒö╝ņ¦łņØś ļČĆĒö╝ Ļ░ÉņåīņÖĆ ĒåĄĻ│äņĀüņ£╝ļĪ£ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņØ┤ĻĖ░ļÅä Ē¢łņ£╝ļ®░[25], ļ»ĖĻĄŁņØś 60ņäĖ ņØ┤ņāüņØś 1192ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņä▒ņØĖņØś ņØĖņ¦Ć ņłśĒ¢ēņŚÉ ļīĆĒĢ£ ņĀäņĀĢ ĻĖ░ļŖźņØś ņśüĒ¢źņØä ĒÅēĻ░ĆĒĢśļŖö ņŚ░ĻĄ¼ņŚÉņä£ ļ│ĆĒśĢļĪ¼ļ▓äĻĘĖ Ļ▓Ćņé¼(modified Romberg test)ļĪ£ Ļ▓Ćņé¼ĒĢ£ ņĀäņĀĢĻĖ░ļŖźĻ│╝ ņł½ņ×ÉļČĆĒśĖņ¦Øņ¦ōĻĖ░ Ļ▓Ćņé¼(digit symbol substitution test, DSS test)ļĪ£ Ļ▓Ćņé¼ĒĢ£ ņØĖņ¦ĆĻĖ░ļŖźņŚÉ ļīĆĒĢ£ ļŗżļ│Ćļ¤ē ļČäņäØņŚÉņä£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀ ĒÖśņ×ÉļŖö 3.4ņĀÉ ļé«ņØĆ DSS Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆņ£╝ļ®░, ņØ┤ Ļ▓░Ļ│╝ļŖö ļģĖĒÖöņŚÉ ļö░ļźĖ 5ļģä ļÅÖņĢłņØś ņØĖņ¦ĆĻĖ░ļŖźļ│ĆĒÖöņÖĆ ļÅÖņØ╝ĒĢ£ Ļ░ÆņØ┤ļŗż(p’╝£0.0001) [26].
ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ļģĖļģäņĖĄņØś ņØĖņ¦Ć ļŖźļĀźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØ┤ Ēü¼Ļ│Ā, ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æņØä ĒżĒĢ©ĒĢ£ ņ╣śļ¦żņØś ņ£äĒŚśņÜöņØĖņØ┤ ļÉĀ ņłś ņ׳ļŗżļŖö Ļ▓¼ĒĢ┤Ļ░Ć ļīĆļæÉļÉśĻ│Ā ņ׳ļŗż[27]. ļćīĻ░äņØś ņĀäņĀĢĒĢĄļ│ĄĒĢ®ņ▓┤(vestibular nuclear complex)ļź╝ ĒżĒĢ©ĒĢ£ ņżæņČö ņĀäņĀĢĻ│äļŖö ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æņØś ņåÉņāüļÉ£ ĒĢ┤ļ¦łņŚÉ ļīĆĒĢ£ ņŻ╝ņÜö ņĮ£ļ”░ņä▒ ņ×ģļĀźņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[28]. ņĀäņĀĢĻĖ░ļŖźņןņĢĀņÖĆ Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀ ļśÉļŖö ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æĻ│╝ Ļ░ÖņØĆ ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀņÖĆ ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØä ļ│┤ņØ┤ļŖö ņŚ░ĻĄ¼ļÅä ņ׳ļŗż. 51ļ¬ģņØś ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æĻ│╝ 26ļ¬ģņØś Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņĀäņĀĢĻĖ░ļŖź ĒÅēĻ░Ć ņŚ░ĻĄ¼ņŚÉņä£ Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀ ĻĘĖļŻ╣ņØĆ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ 3-4ļ░░ņØś ņĀäņĀĢņ£Āļ░£ĻĘ╝ņĀäņ£ä Ļ▓Ćņé¼ņŚÉņä£ ļ╣äņĀĢņāü ņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļ®░, ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æ ĻĘĖļŻ╣ņØĆ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ 4-5ļ░░ņØś ņĀäņĀĢ ņ£Āļ░£ĻĘ╝ņĀäņ£ä Ļ▓Ćņé¼ņŚÉņä£ ļ╣äņĀĢņāü ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż[29]. ĒĢśņ¦Ćļ¦ī ņØ┤ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĀäņĀĢņĢłļ░śņé¼ņØś ņØ┤ļōØņØĆ ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö ņØ┤ņäØĻĖ░Ļ┤Ć, ĒŖ╣Ē׳ ĻĄ¼ĒśĢļéŁņØ┤ ņłśņ¦üņĀü ņżæļĀźņØś ņØĖņŗØņŚÉņä£ ņżæņÜöĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ Ļ│ĄĻ░ä ĻĖ░ņ¢ĄņŚÉņä£ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśĻ│Ā, ĻĄ¼ĒśĢļéŁņØś ĻĖ░ļŖźņןņĢĀĻ░Ć Ļ│ĄĻ░äņØĖņ¦ĆņןņĢĀļź╝ ĒżĒĢ©ĒĢśļŖö ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀņØś ļ░£ļŗ¼ņŚÉ Ļ┤ĆņŚ¼ĒĢ£ļŗżļŖö Ļ░ĆņäżĻ│╝ Ļ┤ĆļĀ©ļÉ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż(Fig. 2) [5,11,13].
ņĀäņĀĢĻĖ░ļŖźņןņĢĀņÖĆ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æ ņé¼ņØ┤ņØś Ļ┤ĆĻ│äņŚÉ ļīĆĒĢ£ ĒĢ£ Ļ░Ćņ¦Ć Ļ░ĆņäżņØĆ ļ▓ĀĒāĆ-ņĢäļ░ĆļĪ£ņØ┤ļō£ņÖĆ Ļ░ÖņØĆ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æņØś ļ│æļ│ĆņØ┤ ņĀäņĀĢĒĢĄĻ│╝ ņŗ£ņāü ļō▒ ņżæņČöņĀäņĀĢņŗĀĻ▓ĮĻ│äļĪ£ ĒÖĢņןļÉśņ¢┤ ņĀäņĀĢĻĖ░ļŖźņØ┤ ņĀĆĒĢśļÉĀ ņłś ņ׳ļŗżļŖö Ļ▓āņØ┤ļŗż[11]. ļćīņØś ņĀäņĀĢ Ļ┤ĆļĀ© ņśüņŚŁņŚÉņä£ ļ▓ĀĒāĆ-ņĢäļ░ĆļĪ£ņØ┤ļō£ ņ╣©ņ░®ņŚÉ Ļ┤ĆĒĢ£ ĻĄ¼ņ▓┤ņĀüņØĖ ņŚ░ĻĄ¼ļŖö ņŚåņ¦Ćļ¦ī, ņĀäņĀĢ ņ×ģļĀźņØä ļ░øļŖö ļćī ņśüņŚŁņØ┤ ļäÉļ”¼ ļČäĒżļÉśņ¢┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æņØś ļ│æļ│ĆņØ┤ ĻĘĖ ņśüņŚŁņ£╝ļĪ£ ĒÖĢņןļÉĀ Ļ░ĆļŖźņä▒ņØ┤ ņČ®ļČäĒĢśļŗż[10]. ļśÉ ļŗżļźĖ Ļ░ĆņäżņØĆ ņĀäņĀĢĻĖ░ļŖźņןņĢĀļĪ£ ņØĖĒĢ┤ ĒĢ┤ļ¦łņÖĆ Ļ░ÖņØĆ ļćīņØś ņśüņŚŁņŚÉ ļīĆĒĢ£ ņĀäņĀĢ Ļ░ÉĻ░ü ņ×ģļĀźņØ┤ Ļ░ÉņåīĒĢśņŚ¼ ļćīņØś ļé┤ņĖĪ ņĖĪļæÉņŚĮ ņŗĀĻ▓Į ļ│Ćņä▒Ļ│╝ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æņŚÉ ņ¦üņĀæņĀüņ£╝ļĪ£ ĻĖ░ņŚ¼ĒĢ£ļŗżļŖö Ļ▓āņØ┤ļŗż[30].
ņĀäņĀĢĻĖ░ļŖźņןņĢĀņÖĆ Ļ│ĄĻ░äņØĖņ¦ĆņןņĢĀļź╝ Ļ░Ćņ¦ä ĒŖ╣ņĀĢ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ļÅä ņ׳ļŗż. Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀņÖĆ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æ ĒÖśņ×É 60ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ Ļ▓ĮļČĆņĀäņĀĢņ£Āļ░£ĻĘ╝ņĀäņ£ä ņŚ░ĻĄ¼ņŚÉņä£ ņ×ÉļÅÖņ░© ņÜ┤ņĀäņŚÉ ļīĆĒĢ£ ņ¢┤ļĀżņøĆņØä ĒÅēĻ░ĆĒĢśļŖö ņäżļ¼Ėņ¦ĆņÖĆ ņŗ£Ļ│ĄĻ░ä ņØĖņ¦Ć ļŖźļĀźņØä ĒÅēĻ░ĆĒĢśļŖö ļ©ĖļŗłļĪ£ļō£ļ¦ĄĻ▓Ćņé¼(Money Road Map test) Ļ▓░Ļ│╝ ņ¢æņĖĪ ĻĄ¼ĒśĢļéŁ ĻĖ░ļŖź ņןņĢĀĻ░Ć ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ ņ×ÉļÅÖņ░© ņÜ┤ņĀäĻ│╝ ņŗ£Ļ│ĄĻ░ä ņØĖņ¦ĆņŚÉ ļŹö ņ¢┤ļĀżņøĆņØä Ļ▓¬ļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļ®░[31], ņČöĻ░Ć ņŚ░ĻĄ¼ņŚÉņä£ Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀņÖĆ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æ ĒÖśņ×Éļź╝ ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒ¢łņØä ļĢī ņĀäņĀĢņ£Āļ░£ĻĘ╝ņĀäņ£ä Ļ▓Ćņé¼ļź╝ ĒżĒĢ©ĒĢ£ ņĀäņĀĢĻĖ░ļŖźĻ▓Ćņé¼ Ļ▓░Ļ│╝ Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀņÖĆ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æ ĒÖśņ×ÉĻ░Ć ņĀäņĀĢĻĖ░ļŖźņØ┤ ļ╣äņĀĢņāüņØ╝ ĒÖĢļźĀņØ┤ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśļ»ĖĒĢśĻ▓ī ļåÆņĢśļŗż[32].
ĒĢ£ĒÄĖ, 1997ļģäĻ│╝ 2013ļģä ņé¼ņØ┤ņŚÉ ļīĆļ¦īņØś ņØĖĻĄ¼ļź╝ ĻĖ░ļ░śņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ░£ļ│æ ĒøäĻĖ░ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æ ņ╣śļ¦żņÖĆ Ļ┤ĆļĀ©ļÉ£ ĻĖ░ņĀĆņ¦łĒÖśņØä ņĪ░ņé¼Ē¢łņØä ļĢī ņĀäņĀĢĻ│äņØś ņןņĢĀ, ņ▓ŁļĀźņĀĆĒĢś, ļČłņĢł, ĻĖ░ļŖźņä▒ ņåīĒÖöņןņĢĀ, ņĀĢņŗĀ ļ│æļ”¼ņĀü ņ”Øņāü, ļćīņ¦äĒāĢ, ņÜöļÅäņØś ņןņĢĀ ļō▒Ļ│╝ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[33].
ļśÉĒĢ£ ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀĻ░Ć ļÅÖļ░śļÉ£ ņ┤łĻĖ░ ĒīīĒé©ņŖ©ļ│æ ĒÖśņ×ÉļōżļÅä ņ¢┤ņ¦Ćļ¤╝ņØä ņ×ÉņŻ╝ Ļ▓¬ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[34]. ņ┤łĻĖ░ ĒīīĒé©ņŖ©ļ│æ ĒÖśņ×ÉļŖö ļé«ņØĆ ņØĖņ¦Ć ĒÅēĻ░Ć ņĀÉņłśļź╝ ļ│┤ņØ┤ļ®░, ņ¢┤ņ¦Ćļ¤╝ ņ”ØņāüņØĆ ĒīīĒé©ņŖ©ļ│æņØś ņØĖņ¦Ć ņĀĆĒĢśņÖĆ Ļ┤ĆļĀ©ļÉ£ ņ×Āņ×¼ņĀüņØĖ ļ╣äņÜ┤ļÅÖ ņ”ØņāüņØ╝ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ņØ┤ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ┤łĻĖ░ ĒīīĒé©ņŖ©ļ│æ ĒÖśņ×É 80ļ¬ģ ņżæ 37ļ¬ģ(46.3%)ņØ┤ ņ¢┤ņ¦Ćļ¤╝ņØä ņĢōņĢśĻ│Ā, ņ¢┤ņ¦Ćļ¤╝ņØś Ļ░Ćņן ĒØöĒĢ£ ņ£ĀĒśĢņØĆ ņŗżņŗĀņĀäļŗ©Ļ│ä(40.5%)ņśĆņ£╝ļ®░, ļ╣äĒŖ╣ņØ┤ņĀü ļśÉļŖö ĻĘĀĒśĢņןņĢĀ ņ£ĀĒśĢņØ┤ ĻĘĖ ļÆżļź╝ ņØ┤ņŚłļŗż.
ņ¢┤ņ¦Ćļ¤╝Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ĻĖ░ĒāĆ ņ¦łĒÖśĻ│╝ ņØĖņ¦Ć ņĀĆĒĢśņÖĆņØś ņŚ░Ļ┤Ćņä▒ĻĖ░ļ”ĮņĀĆĒśłņĢĢĻ│╝ ņ╣śļ¦ż, ļćīņĪĖņżæ, ņØĖņ¦Ć ņĀĆĒĢśņÖĆņØś ņŚ░Ļ┤Ćņä▒ņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ļÅä ņ׳ņŚłļŗż[35]. ņØ┤ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ĻĖ░ļ”ĮņĀĆĒśłņĢĢņØ┤ ņŚåļŖö ņé¼ļ×īņŚÉ ļ╣äĒĢ┤ ĻĖ░ļ”ĮņĀĆĒśłņĢĢņØ┤ ņ׳ļŖö ņé¼ļ×īļōżņØĆ ņ╣śļ¦żņØś ņ£äĒŚśļÅäĻ░Ć 1.54ļ░░, ĒŚłĒśłņä▒ ļćīņĪĖņżæņØś ņ£äĒŚśļÅäļŖö 2.08ļ░░ ļåÆņĢśļŗż. ņŖżņø©ļŹ┤ņØś ņØĖĻĄ¼ļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĻĖ░ļ”ĮļČłļé┤ņä▒ņØĆ Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀņØś ņ£äĒŚśļÅäņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ņŚłņ£╝ļ®░, ĻĖ░ļ”ĮņĀĆĒśłņĢĢņØś ņ”Øņāüļ¦īņ£╝ļĪ£ļÅä ņØĖņ¦Ć ņĀĆĒĢśņØś ņ£äĒŚśņÜöņØĖņ£╝ļĪ£ ļ│┤Ļ│Ā Ļ│ĀļĀ╣ņĖĄņŚÉņä£ ĒśłņĢĢ Ļ┤Ćļ”¼Ļ░Ć ĒĢäņÜöĒĢśļŗżĻ│Ā ĒĢśņśĆļŗż[36]. Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀņŚÉ Ļ┤ĆĒĢ£ ļśÉ ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĻĖ░ļ”ĮņĀĆĒśłņĢĢņØ┤ ņŚåļŖö ĒÖśņ×ÉņŚÉ ļ╣äĒĢ┤ ņ׳ļŖö ĒÖśņ×ÉĻ░Ć Ļ▓ĮļÅäņØĖņ¦ĆņןņĢĀ ĒÖśņ×ÉņŚÉņä£ ņ╣śļ¦żļĪ£ ņĀäĒÖśļÉĀ Ļ░ĆļŖźņä▒ņØ┤ ļæÉ ļ░░ ļåÆļŗżļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņØ┤ĻĖ░ļÅä Ē¢łļŗż[37].
ņĀäņĀĢĒÄĖļæÉĒåĄĻ│╝ ņØĖņ¦ĆņןņĢĀņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĀäņĀĢĒÄĖļæÉĒåĄ ĒÖśņ×ÉņŚÉņä£ ļŗ©ņł£ ĒÄĖļæÉĒåĄ ĒÖśņ×Éļéś Ļ▒┤Ļ░ĢĒĢ£ ņé¼ļ×īļ│┤ļŗż ņØĖņ¦ĆņןņĢĀĻ░Ć ļŹö ļÜ£ļĀĘĒĢśĻ▓ī ļéśĒāĆļé¼ņ£╝ļ®░, ļćīļ░▒ņ¦łņØś ļ│æļ│Ć ļ░£ņāØļźĀņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā, ņéČņØś ņ¦łņØ┤ ņŗ¼Ļ░üĒĢśĻ▓ī ņĀĆĒĢśļÉśņŚłļŗż[38]. ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņ£Āņé¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆņ£╝ļ®░, ņ▓Łņä▒ļćīĻ░äņ£Āļ░£ņĀäņ£ä Ļ▓Ćņé¼ņŚÉņä£ ņĀäņĀĢĒÄĖļæÉĒåĄ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ļŗ©ņł£ ĒÄĖļæÉĒåĄĻ│╝ ļīĆņĪ░ĻĄ░ļ│┤ļŗż I, III, VĒīīņØś ņĀĢņĀÉ ņ×Āļ│ĄĻĖ░Ļ░Ć ņŚ░ņןļÉ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż(p’╝£0.05) [39]. ļśÉĒĢ£ ņĀäņĀĢĒÄĖļæÉĒåĄ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ¢Ėņ¢┤ ņ£Āņ░Įņä▒Ļ│╝ ņŗ£Ļ│ĄĻ░ä ņØĖņ¦Ć Ļ▓Ćņé¼ņŚÉņä£ļÅä ļé«ņØĆ ņĀÉņłśļź╝ ļ│┤ņśĆļŗż.
ņ╣śļ¦żņÖĆ ņ¢æņä▒ļÅīļ░£ļæÉņ£äĒśäĒøłņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ¢æņä▒ļÅīļ░£ļæÉņ£äĒśäĒøł ĒÖśņ×ÉĻ░Ć ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ╣śļ¦żņØś ņ£äĒŚśļÅäĻ░Ć 1.24ļ░░ ļåÆņĢśļŗż(p’╝£0.001) [40]. ĒŖ╣Ē׳ 65ņäĖ ņØ┤ņāü ņ¢æņä▒ļÅīļ░£ļæÉņ£äĒśäĒøł ĒÖśņ×ÉņŚÉņä£ ņ╣śļ¦ż ņ£äĒŚśņØ┤ ņ£ĀņØśļ»ĖĒĢśĻ▓ī ļåÆņĢśļŗż. 11432ļ¬ģņØś ņ╣śļ¦ż ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ĒĢ£ĻĄŁņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ¢æņä▒ļÅīļ░£ļæÉņ£äĒśäĒøłņØś ļ░£ļ│æļźĀņØ┤ 5.3%ļĪ£ ļīĆņĪ░ĻĄ░ 2.6%ņŚÉ ļ╣äĒĢ┤ ņĢĮ 2ļ░░ ļåÆņĢśņ£╝ļ®░, 60ņäĖ ņØ┤ņāüņØś ņØĖĻĄ¼ņŚÉņä£ ņ¢æņä▒ļÅīļ░£ļæÉņ£äĒśäĒøłņØ┤ ņ╣śļ¦żņØś ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż[41].
ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ļé£ņ▓ŁĻ│╝ ļÅģļ”ĮņĀüņ£╝ļĪ£ ņØĖĻ░äņØś Ļ│ĄĻ░ä ĻĖ░ņ¢ĄņØä ĒżĒĢ©ĒĢ£ ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀļź╝ ņØ╝ņ£╝Ēé©ļŗżļŖö ņ”ØĻ▒░Ļ░Ć ņ׳ļŗż[42]. ĒĢ£ĒÄĖņ£╝ļĪ£ ļé£ņ▓ŁĻ│╝ ņĀäņĀĢĻĖ░ļŖźņןņĢĀņØś ņØĖņ¦Ć ņĀĆĒĢśņŚÉ ļīĆĒĢ£ ņ×Āņ×¼ņĀü Ļ▓░ĒĢ® ĒÜ©Ļ│╝ļŖö ņĢäņ¦ü ņל ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖņ¦Ćļ¦ī Ēø©ņö¼ ļŹö Ēü┤ Ļ▓āņ£╝ļĪ£ ņśłņāüļÉ£ļŗżļŖö ņØśĻ▓¼ļÅä ņ׳ļŗż[11].
ņĀäņĀĢĻĖ░ļŖźņןņĢĀņÖĆ ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀņŚÉ ļīĆĒĢ£ Ē¢źĒøä ņŚ░ĻĄ¼ ļ░®Ē¢źņĀäņĀĢĻĖ░ļŖźņןņĢĀļŖö ņ╣śļ¦żņØś ĻĄÉņĀĢ Ļ░ĆļŖźĒĢ£ ņ£äĒŚśņÜöņØĖņØ┤ ļÉĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ļé£ņ▓ŁĻ│╝ ĒĢ©Ļ╗ś ņĀäņĀĢĻĖ░ļŖźņןņĢĀĻ░Ć ņØĖņ¦ĆĻĖ░ļŖźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņŚ░ĻĄ¼ĒĢśļŖö Ļ▓āņØĆ ņżæņÜöĒĢśļŗż[11]. ņĀäņĀĢ ņ¦łĒÖśņŚÉ ļīĆĒĢ£ ņ╣śļŻīļź╝ ĒåĄĒĢ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļź╝ ņśłļ░®ĒĢśĻ▒░ļéś Ļ░£ņäĀĒĢĀ ņłś ņ׳ļŖö ņ×Āņ×¼ļĀźņØ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[43].
ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ņĀäņĀĢņ×¼ĒÖ£ņ╣śļŻīĻ░Ć Ļ▒┤Ļ░ĢĒĢ£ ņä▒ņØĖļōżĻ│╝ ļé£ņ╣śņä▒ ņ¢┤ņ¦Ćļ¤╝ņ”ØņØä ņĢōļŖö ĒÖśņ×ÉļōżņØś ņØĖņ¦ĆĻĖ░ļŖźņØä Ļ░£ņäĀĒĢĀ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒ¢łļŗż[44,45]. ĻĘĖļ”¼Ļ│Ā Ļ░ĆņĀĢņŚÉņä£ ĒĢĀ ņłś ņ׳ļŖö Ļ░Ćņāü Ēśäņŗż ĒöäļĪ£ĻĘĖļשņØä ņØ┤ņÜ®ĒĢ£ ņĀäņĀĢņ×¼ĒÖ£ņØ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ļÅÖļ░śļÉ£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀ ĒÖśņ×ÉņŚÉņä£ ņĀäņĀĢņĢłĻĄ¼ļ░śņé¼, ņ×ÉņäĖ ņ£Āņ¦Ć, ņéČņØś ņ¦ł ļō▒ņØä Ļ░£ņäĀĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉ£ļŗżļŖö ņŚ░ĻĄ¼ļÅä ņ׳ļŗż[46].
ņ╣śļ¦żņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØ┤ļ¬ģ ļ░Å ņ¢┤ņ¦Ćļ¤╝ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņØĆĒ¢ēņ×Ä ņČöņČ£ļ¼╝ņØĖ extract of Ginkgo biloba (EGB) 761 ņĢĮļ¼╝ ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ļ®öĒāĆļČäņäØņŚÉņä£ EGB 761ņØĆ ņ£äņĢĮļ│┤ļŗż ņØ┤ļ¬ģĻ│╝ ņ¢┤ņ¦Ćļ¤╝ņŚÉ ļīĆĒĢ┤ ņÜ░ņłśĒĢ£ Ļ░£ņäĀ ĒÜ©Ļ│╝ļź╝ ļ│┤ņØ┤ĻĖ░ļÅä Ē¢łļŗż[47]. ņØ┤ļŖö ņ╣śļ¦ż ĒÖśņ×ÉņŚÉņä£ ņ¢┤ņ¦Ćļ¤╝ņŚÉ ļīĆĒĢ£ ņĢĮļ¼╝ņ╣śļŻīĻ░Ć ņØĖņ¦ĆņןņĢĀ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ļ│┤ņĪ░ņ╣śļŻīļĪ£ņä£ņØś ļÅäņøĆņØ┤ ļÉĀ Ļ░ĆļŖźņä▒ņØä ļ│┤ņŚ¼ņŻ╝ļ®░, Ē¢źĒøä ņĢĮļ¼╝ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼ļÅä ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
Ļ▓░ ļĪĀņ¢┤ņ¦Ćļ¤╝Ļ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ņé¼ņØ┤ņØś ļåÆņØĆ ņŚ░Ļ┤Ćņä▒ņØĆ ĻĖ░ņĪ┤ņØś ļ│┤Ļ│ĀļōżņØä ĒåĄĒĢ┤ ņĢī ņłś ņ׳ļŗż. ļ¼╝ļĪĀ ņØ┤ ļæśņØś Ļ┤ĆĻ│äĻ░Ć ņāüĒśĖ ņśüĒ¢źņØä ņŻ╝ļŖö Ļ▓āņØĖņ¦Ć, ņĢäļŗłļ®┤ Ļ│ĄĒåĄņØś ņøÉņØĖņŚÉ ņØśĒĢ┤ ņ¢┤ņ¦Ćļ¤╝Ļ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ļÅÖņŗ£ņŚÉ ļ░£ņāØĒĢśļŖöņ¦Ć ņĢäņ¦ü ļģ╝ļ×ĆņØś ņŚ¼ņ¦ĆĻ░Ć ļ¦Äņ¦Ćļ¦ī, ļ│ĄĒĢ®ņĀüņØĖ ņÜöņØĖļōżņØ┤ Ļ┤ĆņŚ¼ĒĢśļŖö ļåÆņØĆ ņŚ░Ļ┤Ćņä▒ņØä Ļ░¢ļŖö Ļ┤ĆĻ│äņØ╝ Ļ░ĆļŖźņä▒ņØ┤ ļåÆņØä Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż.
ļśÉĒĢ£ ņ¢┤ņ¦Ćļ¤╝Ļ│╝ ņĀäņĀĢĻĖ░ļŖźņןņĢĀļŖö ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ļÅģļ”ĮņĀüņ£╝ļĪ£ ļśÉļŖö ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦żņØś ņżæņÜöĒĢ£ ņ£äĒŚśņÜöņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢĀ ņłś ņ׳ļŗż. ļö░ļØ╝ņä£ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś ņśłļ░®ņØä ņ£äĒĢ┤ņä£ļŖö ņ▓ŁĻ░üņ×¼ĒÖ£ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņĀäņĀĢņ×¼ĒÖ£ņÜ┤ļÅÖ ļśÉļŖö ņ¢┤ņ¦Ćļ¤╝ņØä Ļ░£ņäĀĒĢĀ ņłś ņ׳ļŖö ņĢĮļ¼╝ņ╣śļŻī ļō▒ ņ¢┤ņ¦Ćļ¤╝ ņ”ØņāüņŚÉ ļīĆĒĢ£ ņĀüĻĘ╣ņĀüņØĖ ņ╣śļŻī ļśÉĒĢ£ ņżæņÜöĒĢśļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņ¢┤ņ¦Ćļ¤╝ ļśÉļŖö ņĀäņĀĢĻĖ░ļŖźņןņĢĀņØś ļīĆĒĢ£ ņé¼ĒÜīņĀü Ļ┤Ćņŗ¼ņØĆ ļ¼╝ļĪĀ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŖö ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņ¢┤ņ¦Ćļ¤╝ņØś ņśłļ░® ļ░Å ņĀüĻĘ╣ņĀüņØĖ ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢśļŗż. ĻĘĖļ”¼Ļ│Ā ļģĖĒÖöļéś ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņÖĆ Ļ┤ĆļĀ©ļÉ£ ņĀäņĀĢĻĖ░ļŖźņןņĢĀļź╝ ņĪ░ĻĖ░ņŚÉ ņäĀļ│äĒĢĀ ņłś ņ׳ļŖö Ļ▓Ćņé¼ņŚÉ ļīĆĒĢ£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼ ļśÉĒĢ£ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
NotesAuthor Contribution Investigation: Chae Dong Yim. WritingŌĆöoriginal draft: Chae Dong Yim. WritingŌĆöreview & editing: Seong-Ki Ahn. Fig.┬Ā1.The four main vestibular pathways to hippocampus. ADN, anterodorsal nucleus of the thalamus; DTN, dorsal tegmental nucleus;
Interpositus N, anterior and posterior interposed nuclei; LMN, lateral mammillary nuclei; MEC, medial entorhinal cortex; MG, medial geniculate
nucleus; NPH, nucleus prepositus hypoglossi; Parietal C, Parietal cortex; PaS, parasubiculum; Perirhinal, Perirhinal cortex; PoS,
posterior subiculum; PostHT, posterior hypothalamus; Postrhinal, postrhinal cortex; PPTg, pedunculopontine tegmental nucleus; Pulv,
pulvinar; RPO, reticularis pontis oralis; SUM, supramammillary nucleus; ViM, ventralis intermedius nuclei of the thalamus; VLN, ventral
lateral nucleus of the thalamus; VNC, vestibular nucleus complex; VPi, ventral posterior inferior nucleus of the thalamus; VPL, ventral
posterior lateral nucleus of the thalamus; VPM, ventral posterior medial nuclei of the thalamus. Adapted from Hitier et al. Front Integr
Neurosci 2014;8:59[10]. 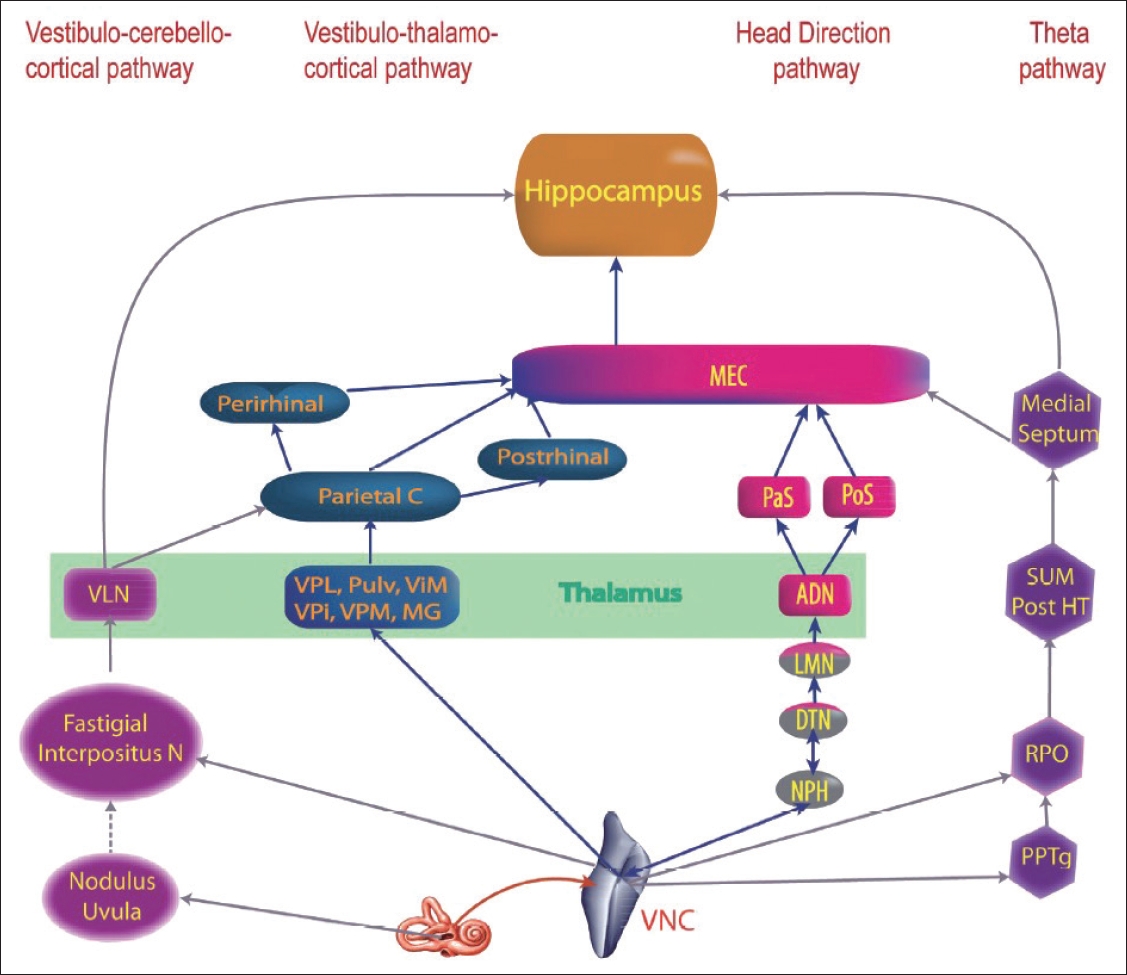
Fig.┬Ā2.Conceptual model of impact of aging on vestibular function. Adapted from Agrawal et al. Aging Ment Health 2020;24(5):705-8, with
permission of Taylor & Francis Ltd[5]. 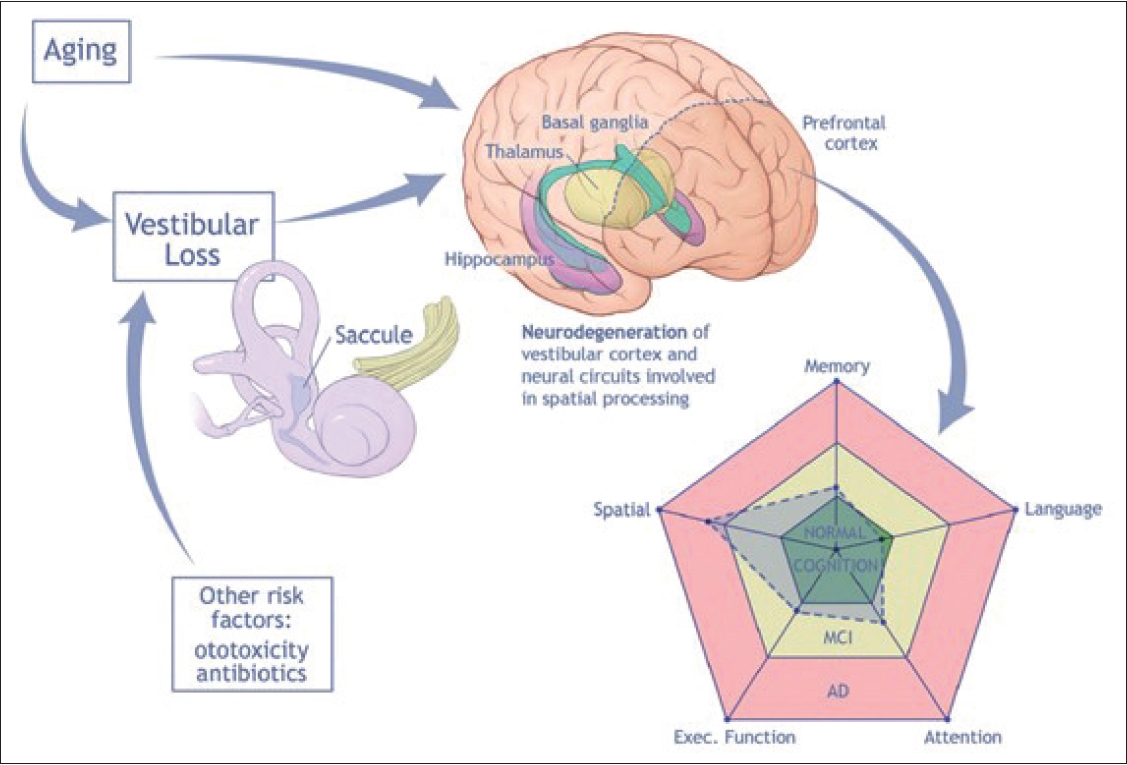
REFERENCES1. Livingston G, Sommerlad A, Orgeta V, Costafreda SG, Huntley J, Ames D, et al. Dementia prevention, intervention, and care. Lancet 2017;390(10113):2673-734.
2. Weidt S, Bruehl AB, Straumann D, Hegemann SC, Krautstrunk G, Rufer M. Health-related quality of life and emotional distress in patients with dizziness: A cross-sectional approach to disentangle their relationship. BMC Health Serv Res 2014;14:317.
3. Iwasaki S, Yamasoba T. Dizziness and imbalance in the elderly: Age-related decline in the vestibular system. Aging Dis 2015;6(1):38-47.
4. French SL, Floyd M, Wilkins S, Osato S. The fear of AlzheimerŌĆÖs disease scale: A new measure designed to assess anticipatory dementia in older adults. Int J Geriatr Psychiatry 2012;27(5):521-8.
5. Agrawal Y, Smith PF, Rosenberg PB. Vestibular impairment, cognitive decline and AlzheimerŌĆÖs disease: Balancing the evidence. Aging Ment Health 2020;24(5):705-8.
6. Agrawal Y, Smith PF, Merfeld DM. Dizziness, imbalance and agerelated vestibular loss. New York: Elsevier; 2020.
7. Agrawal Y, Carey JP, Della Santina CC, Schubert MC, Minor LB. Disorders of balance and vestibular function in US adults: Data from the national health and nutrition examination survey, 2001- 2004. Arch Intern Med 2009;169(10):938-44.
8. Goldberg JM, Wilson VJ, Cullen KE, Angelaki DE, Broussard DM, Buttner-Ennever J, et al. The vestibular system: a sixth sense. Oxford: Oxford University Press; 2012.
10. Hitier M, Besnard S, Smith PF. Vestibular pathways involved in cognition. Front Integr Neurosci 2014;8:59.
11. Smith PF. Why dizziness is likely to increase the risk of cognitive dysfunction and dementia in elderly adults. N Z Med J 2020;133(1522):112-27.
12. Jacob PY, Poucet B, Liberge M, Save E, Sargolini F. Vestibular control of entorhinal cortex activity in spatial navigation. Front Integr Neurosci 2014;8:38.
13. Smith PF. The growing evidence for the importance of the otoliths in spatial memory. Front Neural Circuits 2019;13:66.
14. Morales B. The feasibility of standardized cognitive assessments for vestibular patients [dissertation]. Harrisonburg, VA: James Madison Univ.; 2019.
15. Bigelow RT, Agrawal Y. Vestibular involvement in cognition: Visuospatial ability, attention, executive function, and memory. J Vestib Res 2015;25(2):73-89.
16. Lotfi Y, Rezazadeh N, Moossavi A, Haghgoo HA, Rostami R, Bakhshi E, et al. Preliminary evidence of improved cognitive performance following vestibular rehabilitation in children with combined ADHD (cADHD) and concurrent vestibular impairment. Auris Nasus Larynx 2017;44(6):700-7.
17. Smith PF, Geddes LH, Baek JH, Darlington CL, Zheng Y. Modulation of memory by vestibular lesions and galvanic vestibular stimulation. Front Neurol 2010;1:141.
18. Smith PF, Darlington CL, Zhen Y. The effects of complete vestibular deafferentation on spatial memory and the hippocampus in the rat: The Dunedin experience. Multisens Res 2015;28(5-6):461-85.
19. Brandt T, Smith PF, Denise P, Lopez C, Besnard S. The vestibular system in cognitive and memory processes in mammals. Lausanne: Frontiers Media; 2016. p. 1-246.
20. Stackman RW, Clark AS, Taube JS. Hippocampal spatial representations require vestibular input. Hippocampus 2002;12(3):291-303.
21. Russell NA, Horii A, Smith PF, Darlington CL, Bilkey DK. Longterm effects of permanent vestibular lesions on hippocampal spatial firing. J Neurosci 2003;23(16):6490-8.
22. Russell NA, Horii A, Smith PF, Darlington CL, Bilkey DK. Lesions of the vestibular system disrupt hippocampal theta rhythm in the rat. J Neurophysiol 2006;96(1):4-14.
23. Neo P, Carter D, Zheng Y, Smith P, Darlington C, McNaughton N. Septal elicitation of hippocampal theta rhythm did not repair cognitive and emotional deficits resulting from vestibular lesions. Hippocampus 2012;22(5):1176-87.
24. Kamil RJ, Jacob A, Ratnanather JT, Resnick SM, Agrawal Y. Vestibular function and hippocampal volume in the Baltimore Longitudinal Study of Aging (BLSA). Otol Neurotol 2018;39(6):765-71.
25. Jacob A, Tward DJ, Resnick S, Smith PF, Lopez C, Rebello E, et al. Vestibular function and cortical and sub-cortical alterations in an aging population. Heliyon 2020;6(8):e04728.
26. Semenov YR, Bigelow RT, Xue QL, du Lac S, Agrawal Y. Association between vestibular and cognitive function in US adults: Data from the national health and nutrition examination survey. J Gerontol A Biol Sci Med Sci 2016;71(2):243-50.
27. Previc FH. Vestibular loss as a contributor to AlzheimerŌĆÖs disease. Med Hypotheses 2013;80(4):360-7.
28. Chapleau M, Aldebert J, Montembeault M, Brambati SM. Atrophy in AlzheimerŌĆÖs disease and semantic dementia: An ALE metaanalysis of voxel-based morphometry studies. J Alzheimers Dis 2016;54(3):941-55.
29. Wei EX, Oh ES, Harun A, Ehrenburg M, Agrawal Y. Vestibular loss predicts poorer spatial cognition in patients with AlzheimerŌĆÖs disease. J Alzheimers Dis 2018;61(3):995-1003.
30. Cui B, Zhu L, She X, Wu M, Ma Q, Wang T, et al. Chronic noise exposure causes persistence of tau hyperphosphorylation and formation of NFT tau in the rat hippocampus and prefrontal cortex. Exp Neurol 2012;238(2):122-9.
31. Wei EX, Oh ES, Harun A, Ehrenburg M, Agrawal Y. Saccular impairment in AlzheimerŌĆÖs disease is associated with driving difficulty. Dement Geriatr Cogn Disord 2017;44(5-6):294-302.
32. Wei EX, Oh ES, Harun A, Ehrenburg M, Xue QL, Simonsick E, et al. Increased prevalence of vestibular loss in mild cognitive impairment and AlzheimerŌĆÖs disease. Curr Alzheimer Res 2019;16(12):1143-50.
33. Liao JY, Lee CT, Lin TY, Liu CM. Exploring prior diseases associated with incident late-onset AlzheimerŌĆÖs disease dementia. PLoS One 2020;15(1):e0228172.
34. Kwon KY, Park S, Lee M, Ju H, Im K, Joo BE, et al. Dizziness in patients with early stages of ParkinsonŌĆÖs disease: Prevalence, clinical characteristics and implications. Geriatr Gerontol Int 2020;20(5):443-7.
35. Rawlings AM, Juraschek SP, Heiss G, Hughes T, Meyer ML, Selvin E, et al. Association of orthostatic hypotension with incident dementia, stroke, and cognitive decline. Neurology 2018;91(8):e759-68.
36. Elmst├źhl S, Widerstr├Čm E. Orthostatic intolerance predicts mild cognitive impairment: Incidence of mild cognitive impairment and dementia from the Swedish general population cohort Good Aging in Sk├źne. Clin Interv Aging 2014;9:1993-2002.
37. Hayakawa T, McGarrigle CA, Coen RF, Soraghan CJ, Foran T, Lawlor BA, et al. Orthostatic blood pressure behavior in people with mild cognitive impairment predicts conversion to dementia. J Am Geriatr Soc 2015;63(9):1868-73.
38. Wang N, Huang HL, Zhou H, Yu CY. Cognitive impairment and quality of life in patients with migraine-associated vertigo. Eur Rev Med Pharmacol Sci 2016;20(23):4913-7.
39. Zhang L, Chen QH, Lin JH, Zhou C, Pan YH. Research on the relationship between vestibular migraine with/without cognitive impairment and brainstem auditory evoked potential. Front Neurol 2020;11:159.
40. Lo MH, Lin CL, Chuang E, Chuang TY, Kao CH. Association of dementia in patients with benign paroxysmal positional vertigo. Acta Neurol Scand 2017;135(2):197-203.
41. Kim SY, Yoo DM, Min C, Choi HG. Increased risk of neurodegenerative dementia after benign paroxysmal positional vertigo. Int J Environ Res Public Health 2021;18(19):10553.
42. Smith PF. Hearing loss versus vestibular loss as contributors to cognitive dysfunction. J Neurol 2022;269(1):87-99.
43. Hillier S, McDonnell M. Is vestibular rehabilitation effective in improving dizziness and function after unilateral peripheral vestibular hypofunction? An abridged version of a Cochrane review. Eur J Phys Rehabil Med 2016;52(4):541-56.
44. Sugaya N, Arai M, Goto F. Changes in cognitive function in patients with intractable dizziness following vestibular rehabilitation. Sci Rep 2018;8(1):9984.
45. Rogge AK, R├Čder B, Zech A, Nagel V, Hollander K, Braumann KM, et al. Balance training improves memory and spatial cognition in healthy adults. Sci Rep 2017;7(1):5661.
46. Micarelli A, Viziano A, Micarelli B, Augimeri I, Alessandrini M. Vestibular rehabilitation in older adults with and without mild cognitive impairment: Effects of virtual reality using a head-mounted display. Arch Gerontol Geriatr 2019;83:246-56.
47. Spiegel R, Kalla R, Mantokoudis G, Maire R, Mueller H, Hoerr R, et al. Ginkgo biloba extract EGb 761® alleviates neurosensory symptoms in patients with dementia: A meta-analysis of treatment effects on tinnitus and dizziness in randomized, placebo-controlled trials. Clin Interv Aging 2018;13:1121-7.
|
|
||||||||||||||||||||||||||||||||||||||||||||

 |
 |