국소 알레르기비염의 최신지견
Current Update of Local Allergic Rhinitis
Article information
Trans Abstract
Local allergic rhinitis (LAR) is a localized nasal allergic response in the absence of systemic atopy. The symptoms, duration, severity, and comorbidities of LAR are similar to those of allergic rhinitis. Although pathophysiology of LAR is not fully understood, in some patients specific IgE can be demonstrated in the nasal secretions. The diagnosis currently relies on the positive results of nasal provocation test. Nasal provocation test has shown high sensitivity and specificity with safety, and is considered as the gold standard. LAR patients benefit from the same therapeutic strategies as allergic rhinitis patients, including the avoidance of allergen exposure and the pharmacotherapy. Effectiveness and safety of allergen immunotherapy open a window of treatment opportunity in LAR. This review provides a current update on LAR.
서 론
비염은 고전적으로 알레르기비염과 비-알레르기비염으로 분류되며, 알레르기비염의 진단에서 가장 중요한 두 가지 검사는 피부단자검사와 혈청 특이 IgE 검사이다[1]. 일반적으로 둘 중 하나 이상이 양성으로 확인되어야 알레르기비염으로 진단할 수 있고, 둘 다 음성인 경우 비-알레르기비염으로 진단한다[2]. 하지만, 피부단자검사와 혈청 특이 IgE가 모두 음성인 비-알레르기비염 환자 중에서도 알레르기비염 증상을 보이는 경우가 관찰되며, 일부에서 비강유발검사상 양성인 것이 확인된다. 이처럼 전신적인 아토피가 없으나 국소적 알레르기비염 증상이 있는 상태를 국소 알레르기비염으로 정의하며, 고전적인 알레르기비염 및 비-알레르기비염의 분류 중 어느 쪽에도 속하지 않는다[3,4]. Huggins 등이 처음으로 국소 알레르기비염의 개념을 제시하였고, 이후 Rond´on 등에 의해서 국소 알레르기비염으로 정의되었다[5-7].
최근 수년간 국소 알레르기비염에 대한 연구가 활발히 진행되고 있으며, 국소 알레르기비염의 역학, 병태생리, 진단 및 치료, 더 나아가 면역치료 효과 등에 대한 최근 연구 동향을 소개하고자 한다.
역 학
국소 알레르기비염에 대한 연구가 진행되면서 비염 환자 중에서 국소 알레르기비염이 차지하는 비율이 보고되고 있다. 국내에서 시행된 연구에서 Jung 등[8]은 전체 150명의 비염 환자 중에서 4%가 집먼지진드기에 대한 국소 알레르기비염으로 진단되었다고 보고하였고, Kim과 Jang [9]은 국소 알레르기비염이 전체 비염 환자의 3.5%를 차지한다고 보고하였다. 중국에서는 Tao 등[10]이 194명의 비염 환자를 대상으로 시행한 연구에서 7.7%가 국소 알레르기비염으로 진단되었고, Cheng 등[11]의 연구에서는 국소 알레르기비염이 전체 비염의 8.2%를 차지하였다.
서양에서는 국소 알레르기비염이 차지하는 비율이 동양보다 상대적으로 더 높게 보고되었다. Rond´on 등[12]은 428명의 비염 환자 중 25.7%에서 국소 알레르기비염으로 진단하였고, Bozek 등[13]의 연구에서는 621명의 비염 환자 중 17.6%가 국소 알레르기비염으로 확인되었다. 그 외에도 Hamizan 등[14,15]이 보고한 체계적 문헌 고찰에서, 3400명 및 648명을 대상으로 분석하여 국소 알레르기비염이 전체 비염의 각각 24.7%와 10.2%의 비율을 차지하였다.
연구 설계 방법이나 진단 방법 등에서 존재하는 차이로 인하여 연구 간 유병률 차이가 나타나며, 동양이 서양에 비하여 비교적 낮은 유병률을 보이는 것은 민족적인 혹은 환경적인 요인에 기인한다. 추후 대규모 연구가 필요하며, 그럼에도 불구하고 다양한 연구들은 우리나라를 포함한 많은 국가에서 국소 알레르기비염이 전신적 아토피가 없는 비-알레르기비염 환자의 상당 부분을 차지한다는 것을 명확히 보여준다.
임상 양상 및 동반 질환
국소 알레르기비염 환자의 증상은 콧물, 가려움증, 재채기 및 코막힘 등으로 알레르기비염 환자의 증상과 비슷하고, 지속적이며 통년성 양상을 보이는 경우가 많다[16,17]. 아동기 때부터 증상을 보이는 경우가 36%로 비교적 높고, 비흡연자 여성에게 가장 흔하다[12]. 대표적인 동반 질환으로는 결막염과 천식이 있으며, 가장 흔한 항원은 집먼지진드기(D. pteronyssinus)이다[18].
Rond´on 등[18,19]은 국소 알레르기비염 환자를 10년간 관찰하여, 전신적인 아토피로 전환되는 경우는 9.7%였으며 대조군의 7.8%와 비교하여 유의한 차이가 없었다. 따라서 국소 알레르기비염은 알레르기비염의 시작 단계가 아닌 독자적인 표현형이다. 또한 10년 기간 동안에 지속적인 비염의 증상은 64.8%에서 88.6%로 증가하였고, 중증 환자도 1.9%에서 4.2%로 유의하게 증가하였다. 천식 의심 증상을 보이는 환자는 18.8%에서 30.7%로 유의하게 증가하였고, forced expiratory volume in one second(FEV1)도 94.1%에서 89.1%로 유의하게 감소하였다. 그 외에도 국소 알레르기비염 환자에서 결막염 유병률도 52.3%에서 61.9%로 증가하였다. 특히 국소 알레르기비염 환자에서 삶의 질 장애가 발생한 비율이 55.1%에서 85.2%로 유의하게 증가하였다[19].
Campo 등[20]은 기관지 증상을 호소하는 국소 알레르기비염 환자 중 50%가 메타콜린 유발 검사에서 양성 반응을 보여 천식으로 진단되었다. 기관지 항원 유발검사상 비-알레르기비염 환자 혹은 건강한 대조군에서는 한 명도 관찰되지 않은 반면, 국소 알레르기비염 환자에서는 28%에서 양성을 보여 국소 알레르기비염 환자에서도 상기도와 하기도 사이에 병태생리적 연결고리가 있음을 뒷받침한다[21].
요약하면 국소 알레르기비염 환자는 알레르기비염 환자에서 보이는 콧물, 가려움증, 재채기 및 코막힘 등의 증상을 보이고, 장기적으로 비염 증상 자체의 악화 및 기관지 증상 유발 등이 동반되며, 궁극적으로 삶의 질이 저하되고 결막염 및 천식 등의 질환이 동반된다.
병태생리
Huggins와 Brostoff [5]는 처음으로 전신적인 아토피가 없는 비염 환자의 콧물에서 특이 IgE를 확인하였고, 전신적인 아토피를 보이지 않는 비염 환자의 코점막에서 특이 IgE의 침윤이 증가한 증례가 보고되었다[22,23]. 이후 국소 알레르기비염이 정의되면서 비강 특이 IgE 항체와의 연관성을 찾기 위한 많은 노력이 있었다. Rond´on 등[3,16]은 국소 알레르기비염 환자 중에서 통년성 환자의 22%, 그리고 계절성 환자의 35%에서 콧물 특이 IgE 항체를 검출하였다. 그 외에도 국소 알레르기비염 환자에서의 특이 IgE를 찾으려는 연구들에서 비교적 낮은 발견율을 보였으며, 국소 알레르기비염 환자의 병태생리 내에서 특이 IgE의 관여도에 의문이 제기되었다[24].
국소 알레르기 반응에서의 면역학적 역할이 명확히 밝혀지지는 않았지만, 국소 알레르기비염의 발생기전에 특이 IgE가 관여한다. 국소 알레르기비염 환자의 일부에서 특이 IgE-매개 호염기구 반응검사에 양성을 보이고 Wortmannin(PI3K blocker preventing IgE-dependent activation)을 첨가하면 호염기구 반응이 억제되며, 이는 점막의 특이 IgE가 혈행으로 도달함을 의미한다[25-27].
알레르기비염 환자의 코점막에서 국소적인 면역 글로불린 종류 변환(class switch recombination)이 발생하며[28,29], 점막에서 만들어진 특이 IgE는 림프체계를 통해 혈행으로 퍼지고, 궁극적으로 말초 조직으로 퍼져 피부 등에 존재하는 비만세포를 감작시키거나 호염기구를 통해 순환한다[30,31]. 천식 환자에서 전신적인 아토피 상태와 상관없이 기관지 점막내에서 면역 글로불린 종류변환이 일어난다는 근거가 확인되었고[32], 국소 알레르기비염 환자 코점막에서도 효과기 세포를 감작시키는 수준의 특이 IgE 생성이 가능하지만, 피부 등 말초 비만세포에 도달하거나 혈행에서 관찰되지 않는 수준일 것으로 추정된다(Fig. 1).
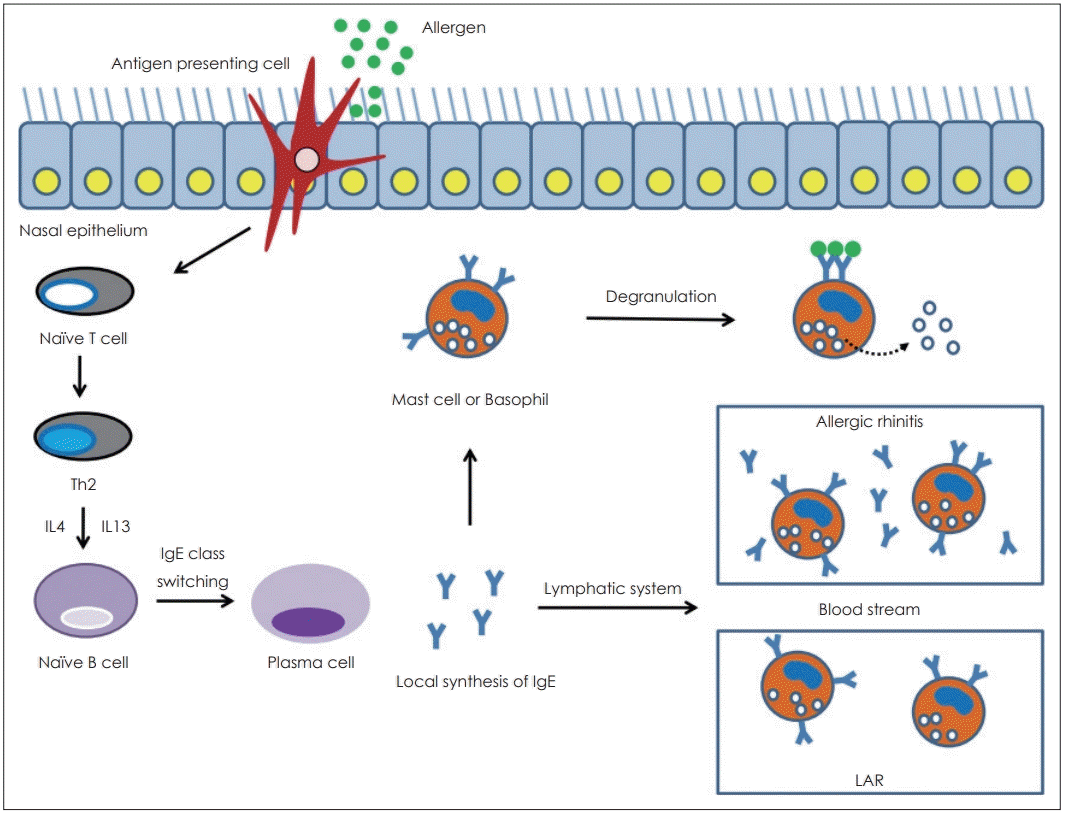
The IgE-mediated hypersensitivity response has been found to occur in nasal mucosa of LAR patients. After saturating the receptor system of basophils in serum and mast cells in peripheral tissues, IgE can be found at a free state in blood stream of allergic rhinitis patients. On the contrary, in LAR patients, IgE is not enough to be shown at a free state in serum. LAR: local allergic rhinitis.
진 단
피부단자검사와 혈청 특이 IgE가 음성으로 전신적인 아토피가 없는 환자 중에서 알레르기비염의 증상이 있을 때에 국소 알레르기비염을 의심할 수 있으며, 진단에서 가장 중요한 검사는 비강유발검사이다. 비강에 항원을 투여하여 코점막을 항원에 노출시켜 발생하는 임상증상의 변화와 비강 저항, 부피 및 단면적 등의 변화를 측정하여 알레르기 반응을 평가한다[33]. 비강유발검사는 국소 알레르기비염을 진단하는 데에 민감도와 특이도가 가장 높은 검사이며[34-36], European Academy of Allergy and Clinical Immunology(EAACI)는 국소 알레르기비염 진단의 가장 중요한 기준으로 제시하였다[37].
전신적인 아토피를 보이지 않는 비염 환자에서 비강유발검사상 양성이 나오는 비율, 즉 비-알레르기비염 환자 중에서 비강유발검사를 통하여 국소 알레르기비염으로 진단되는 유병률이 3.5%~50.0% 정도까지 매우 다양하다[3,7-9,17]. 이는 각 연구자마다 사용하는 항원의 종류 및 농도가 다르고 유발전후 평가하는 척도 등이 차이가 있기 때문이다[38]. EAACI에서는 이를 보완하고자 비강유발검사의 절차를 정립하였다[37]. 항원은 다양한 제조업체에서 표준화된 용액으로 판매되고, 비강유발검사와 같이 임상적인 목적으로 사용하는 경우에는 제조업체의 지침을 참고하여 사용한다. 항원의 적용방법은 펌프-에어로졸 스프레이(pump-aerosol spray) 형태가 가장 편하고 신뢰할 수 있으며, 한번의 펌프로 50 μL를 분사한다. 검사 시에는 콧구멍 당 두번씩 분사하며(하비도 1회 및 중비도 1회), 기계적 자극을 방지하기 위해 비중격 방향으로 분사하는 것을 피한다. 검사 과정은 기준 측정, 대조 검사와 항원검사의 3가지 단계로 구성되고 각 단계에서 주관적인 척도와 객관적인 척도를 이용하여 반응 여부를 평가하며, Fig. 2와 같은 프로토콜에 따라 검사 결과를 판정한다. 반응을 평가하는 주관적인 척도로는 시각아날로그척도 혹은 총 코증상 점수 등을 이용하고, 객관적인 척도로는 비강최대흡기유속검사, 비강통기도검사, 음향비강통기도검사 및 4단계-비강통기도검사를 이용하여 코개방성을 측정한다(Table 1). 이후 주관적인 증상과 객관적인 척도 변화에 따라 반응을 판정하며, 주관적인 증상 혹은 객관적인 척도 둘 중 하나라도 강한 반응을 보이거나, 혹은 둘 다 중등도 이상의 반응을 보이는 경우에 양성 반응으로 판정한다[37].
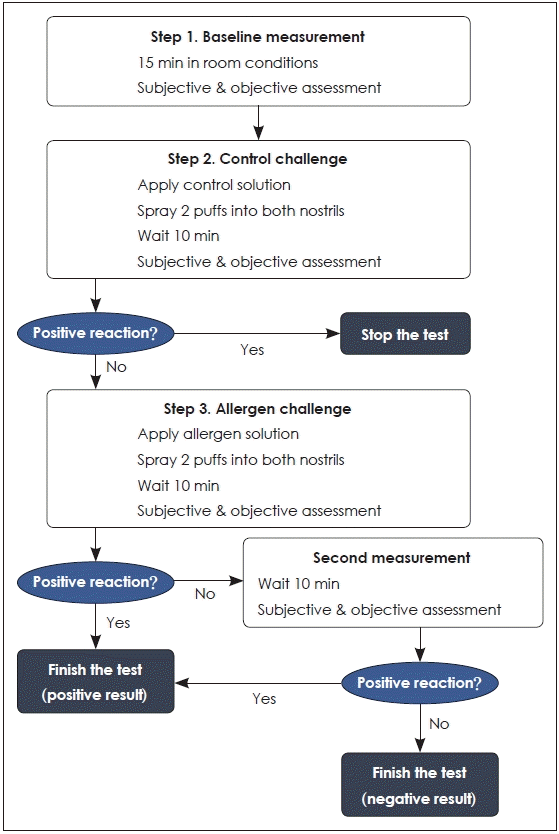
Procedure of nasal provocation test (modified from the position paper of European Academy of Allergy and Clinical Immunology).

Recommendations for interpretation of subjective and objective assessment after nasal allergen challenge (cited from the position paper of European Academy of Allergy and Clinical Immunology)
Eguiluz-Gracia 등[39]의 연구에서 성인 5830명과 소아 518명을 대상으로 11499번의 비강유발검사를 시행하여 1547명에서 증상이 유발되었으나 99.9%에서 증상이 안정적으로 조절되어 매우 안전한 검사임을 확인하였다. 비강유발검사는 국소 알레르기비염의 진단에 가장 중요한 검사로, 안전하고 우수하며 임상에서 시행하기에도 어렵지 않은 검사이다. 정형화된 비강유발검사를 이용하여 더 큰 대규모 연구가 시행된다면 보다 정교하고 우수한 진단 기준을 정립할 수 있을 것이다.
비강유발검사 외에도 비강에서 특이 IgE를 검출하는 것도 진단에 도움이 되며 콧물이나 코 점막조직 등을 이용한 다양한 방법이 연구되고 있으나, 국소 알레르기비염의 진단에 사용하기에는 민감도가 다소 낮고 임상에서 사용하기에도 어려운 문제점이 있다. 실제로 콧물 특이 IgE를 이용한 경우 민감도가 22%~40%이며[3,16], 비강유발을 시행한 이후에 특이 IgE를 측정한 경우에도 비슷한 정도로 낮게 측정되었는데, 이는 희석효과 등이 원인으로 추정된다[40,41].
다른 보조적인 방법으로는 유세포 분석을 기반으로 하는 호염기구 활성화 검사가 있다. 항원으로 자극한 후 호염기구 표면에 나타나는 CD63 혹은 CD203c의 활성 표지자를 측정하는 검사로, CD63은 IgE-매개 알레르기 반응과 매우 연관이 높다[42]. 국소 알레르기비염의 진단에서 호염기구 활성화 검사의 민감도는 50.0%~66.6%이고, 특이도는 90.0%~91.7%이다[26]. 그러나 호염기구 활성화 검사는 실험실적으로만 사용하고 임상적인 목적으로는 사용이 어렵다.
치 료
국소 알레르기비염과 알레르기비염은 많은 공통된 임상적 및 병태생리학적 특성을 보이며, 치료도 비슷하다[4]. 알레르기비염 치료와 같이 비강 국소 스테로이드분무제 및 경구 항히스타민제는 증상 조절에 도움이 되며, 항원 회피요법도 병행하는 것이 권장된다[3,16]. 하지만, 단순한 증상 조절은 국소 알레르기비염의 병적 진행을 막을 수 없고 항원 회피요법도 불가피한 상황이 있을 수밖에 없으며, 장기적으로 동반 질환이 발생하고 비염 증상을 악화시킨다.
면역치료는 알레르기비염과 천식의 자연진행 과정을 변화시킬 수 있는 근본적인 치료법으로 국소 알레르기비염에서도 치료 방법으로 제시되어, 국소 알레르기비염 환자에서 피하 면역치료의 효과를 분석하는 연구들이 진행되었다(Table 2) [43-47]. Rond´on 등[43]은 목초 꽃가루에 대한 반응성이 있는 국소 알레르기비염 환자를 대상으로 6개월간의 피하 면역치료 후 약물치료를 추가한 군에서 약물치료만 시행한 군보다 증상 및 객관적인 지표에서 더 양호한 결과를 보였다. 이후 피하 면역치료가 국소 알레르기비염의 치료에 이득이 있을 것으로 생각하고 추가적인 연구를 시행하였다. Rond´on 등[44]은 2016년에 집먼지 진드기(D. pteronyssinus)를 항원으로 피하 면역치료 후 6개월째부터 치료군에서 코 증상 및 약물복용점수가 현저히 감소하였고, 비강유발검사에 대한 관용성은 증가하였다. 12개월째부터는 혈청 특이 IgG4 수치도 대조군에 비하여 증가하였다. 2018년에는 56명의 환자를 A그룹과 B그룹으로 나누어 분석하였고, A그룹은 플레옴(Phleum pratense)을 항원으로 2년간 피하 면역치료를 받았고, B그룹은 1년은 위약치료를 받은 후 1년은 피하 면역치료를 받았다. 첫 해는 A그룹에서 B그룹과 비교하여 코 증상 및 약물복용점수가 유의하게 감소하였고, 천식 조절도 유의미한 차이가 있었다. 두 번째 해에는 두 그룹 모두 면역치료를 받았으며, 첫 번째 해에 비교하여 두 그룹 모두 코 증상 및 약물복용점수가 유의하게 감소하였다. 이를 통해 피하 면역치료가 단기간 및 장기간 모두에 효과가 있음을 입증하였다[45].
Bozek 등[46,47]이 자작나무(Betula verrucosa)를 항원으로 시행한 두 임상시험에서도 유의한 치료효과를 보였다. 2018년에 보고한 임상시험에서는 24개월 동안 면역치료를 시행한 치료군에서 코증상 및 약물복용점수가 유의하게 감소하였고, 혈청 특이 IgG4가 증가하지만 비강 특이 IgE는 감소하였다[46]. 2020년 연구에서는 3년간의 면역치료를 시행한 그룹과 위약군을 비교하여 앞선 연구와 비슷한 임상적 및 면역학적 결과를 얻었고, 치료군에서 피하 면역치료 이후에 기관지 반응성이 유의하게 감소하였다[47].
이처럼 피하 면역치료는 증상점수, 약을 복용하지 않는 날짜, 삶의 질, 비강유발검사에 대한 관용성 등 다양한 임상적 치료효과를 보이며, 혈청 및 비강 특이 IgE가 감소하고 혈청 특이 IgG4가 증가하는 등의 면역학적 치료효과를 보였다. 기관지 반응성을 감소시키고 천식을 조절하는 효과도 보이고, 면역치료 시에 단 몇 건의 국소 반응 외에 중대한 부작용이 발생하지 않아 안전한 치료이다. 따라서 피하 면역치료는 치료효과와 안전성이 입증된 국소 알레르기비염의 중요한 치료 옵션이다. 피하 면역치료 종결 후 치료 효과가 장기간 유지되는지, 설하 면역치료도 비슷한 치료효과가 있는지, 또는 수술적 치료는 어떠한 역할을 할 수 있는지 등에 대하여는 추후 연구가 필요하다.
결 론
국소 알레르기비염은 전체 비염 환자의 상당한 부분을 차지하고 있음에도 불구하고 진단이나 치료와 같은 임상적인 연구가 부족하다. 국소 알레르기비염은 주로 아동기에 시작되어서 점차 악화되며 기관지 증상 유발이나 결막염과 같은 질환을 동반한다. 가장 중요한 진단방법은 비강유발검사로 적절한 약물치료와 면역치료를 통해 질병의 진행을 막는 것이 중요하다.
Acknowledgements
None.
Notes
Author Contribution
Conceptualization: all authors. Data curation: Jee Won Moon. Formal analysis: all authors. Funding acquisition: Heung-Man Lee. Investigation: Su-Jong Kim, Jee Won Moon. Methodology: HeungMan Lee. Project administration: Su-Jong Kim, Heung-Man Lee. Resources: Su-Jong Kim. Software: Jee Won Moon. Supervision: Heung-Man Lee. Validation: Heung-Man Lee. Visualization: SuJong Kim, Jee Won Moon. Writing—original draft: Su-Jong Kim. Writing—review & editing: Su-Jong Kim.

