만성 중이염의 술후 감염 발생 환자에 대한 항생제 선택에 대한 고찰
A Study on Antibiotics Selection for Patients With Chronic Otitis Media With Postoperative Infection
Article information
Trans Abstract
Background and Objectives
Few studies have been reported on the strains that cause postoperative infection after chronic otitis media (COM) surgery. This study examined the direction of empirical antibiotics selection for patients with postoperative infection.
Subjects and Method
This was a retrospective study of 33 patients who were admitted for antibiotics therapy after suffering intractable post-operative infection of COM surgery at Chonnam National University Hospital from 2011 to 2021. Demographic data and microbial culture results of pre-operation and post-operative infection, as well as selected antibiotics for different time periods were evaluated.
Results
Most common pathologic organisms responsible for post-operative infection were Methicillin-resistant Staphylococcus aureus (MRSA) (45.5%) and Ciprofloxacin-resistant Pseudomonas aeruginosa (CRPA) (12.1%). Interestingly, there were only three cases where pre- and post-operative culture tests were the same, testing positive for two MRSA and one CRPA. The antibiotics selected as empirical antibiotics for postoperative infection were ceftazidime (48.5%) and vancomycin (27.3%). The rate of the cases where the selected empirical antibiotic was sensitive to the strain was 63.6%, and the rate of changing the antibiotics according to the microbial culture test result was 39.4%.
Conclusion
The strains cultured from the otorrhea of post-operatively infected patients had a very high ratio of drug-resistant strains and were different from the strains cultured from the otorrhea before surgery. Therefore, a microbial culture test is essential when an infection occurs after surgery, and regardless of the preoperative culture test results, patients with intractable postoperative infections should be treated with empirical vancomycin.
서 론
만성 중이염에서 합병증과 재발을 줄이고 적절한 치료를 시행하기 위해서는 효과적인 항생제를 사용하는 것이 필수적이다. 항생 물질의 개발과 함께 이에 대한 내성균이 연이어 출현하고 세균총의 변화도 계속해서 일어나고 있다. 그래서 변화하는 세균총에 대한 정보와 세균 검사가 적절한 항생제를 선택하는 데 필수적이다[1]. 이에 대해 그동안 많은 저자들이 만성 화농성 중이염에 대한 세균학적인 고찰을 시행하여 왔으나[2,3], 만성 중이염에 대한 술후 감염이 발생한 환자의 이루에 대한 세균학적인 연구는 드문 실정이다. 이에 따라 본 연구에서는 술후 감염 환자에게서 배양된 균주의 종류를 조사하여 초기 항생제 선택에 대한 방향성을 고찰해보고자 하였다.
대상 및 방법
대 상
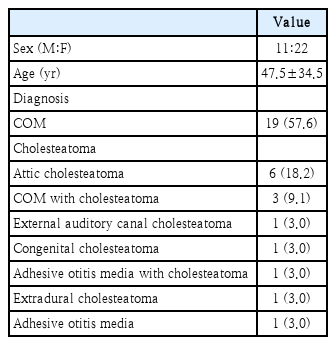
2012년 1월부터 2021년 9월까지 만성 중이염에 대한 수술적 치료 시행 후 2개월 이내에 감염이 발생하여 통원 치료에도 불구하고 염증이 호전되지 않아 전남대학교병원 이비인후과에 입원하여 항생제 치료를 시행한 환자들의 의무기록을 후향적으로 분석하였다. 10년 동안 총 33명의 환자들이 입원하여 항생제 치료를 시행 받았다. 표본을 대상으로 술전 진단명, 성별, 나이, 기저 질환 유무(고혈압, 당뇨)를 확인하였다.
수술 전 병의 진단명으로는 만성 화농성 중이염이 19건으로 가장 많았고, 진주종성 중이염이 13건, 유착성 중이염 1건으로 확인되었다(Table 1).
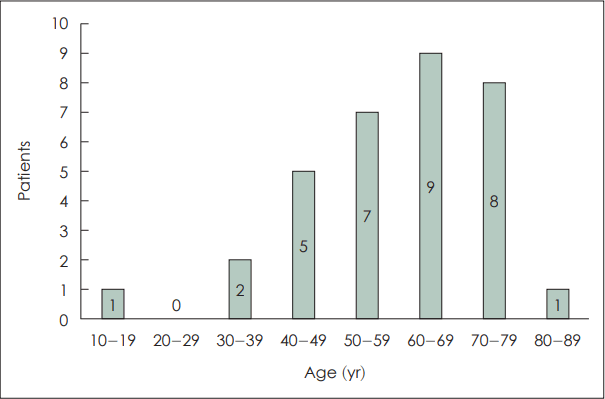
총 33명의 환자군 중 남자는 11명(33.3%), 여자는 22명(66.7%)이었다. 평균 나이는 47.5세(±34.5)로 10대는 1명(3%), 20대는 0명(0%), 30대는 2명(6.1%), 40대는 5명(15.2%), 50대는 7명(21.2%), 60대는 9명(27.3%), 70대는 8명(24.2%), 80대는 1명(3%)의 분포를 보이고 있었다(Fig. 1).
기저 질환 및 상태로는 고혈압 5명(15.2%), 당뇨 3명(9.1%)으로 조사되었다.
방 법
환자군을 대상으로 술전 미생물 배양 검사 여부, 수술 후 사용한 1차 항생제, 술후 감염 발생 후 시행한 미생물 배양 검사에서 배양된 균주의 종류, 술후 감염 발생 시 초기 선택한 2차 경험적 항생제, 배양 검사 결과에 따라 변경한 3차 항생제를 확인하였다. 총 치료 기간은 입원 기간 동안 항생제를 사용한 총 일 수로 정의하였다. 항생제 투여 종료 기준은 항생제 사용 후에 환자의 임상 증상(이통, 두통, 열감 등)과 징후(이루, 봉합 부위 삼출물, 종창 및 발적, 염증 수치)의 호전을 종합적으로 판단하여 종료 시점을 결정하였다.
검체 채취는 외이도 또는 술후 창상 내부의 삼출물에 대해 주위 피부와 접촉을 방지하면서 멸균된 면봉으로 시행하였으며, TransystemTM sterile transport swab (COPAN Diagnostics, Murrieta, CA, USA)을 사용하였다.
통계 분석
통계 분석은 통계 분석 프로그램 R (ver. 4.1.2)을 이용하여 시행하였다. 술후 감염 발생 후 경험적 항생제로 vancomycin을 선택했을 때와 ceftazidime을 선택했을 때 총 치료 기간의 차이를 독립 표본 T검정을 사용하여 검정하였다. 또한 술 후 감염 발생 후 시행한 배양 검사상 Methicillin-resistant Staphylococcus aureus (MRSA)가 검출되었을 때와 Ciprofloxacin-resistant Pseudomonas aeruginosa (CRPA)가 검출되었을 때 총 치료 기간의 차이를 독립 표본 T검정을 사용하여 검정하였다. 마지막으로 술후 감염 발생 후 시행한 배양 검사에서 MRSA가 검출되었을 때, 처음부터 vancomycin을 사용한 군의 치료 기간과 배양 검사가 나온 뒤 항생제를 vancomycin, teicoplanin으로 교체한 군의 치료 기간을 독립 표본 T검정을 사용하여 검정하였다. 각 분석에서 p값이 0.05 미만인 경우 통계적으로 유의한 것으로 정의하였다. 본 연구는 전남대학교병원 임상 연구심의위원회(IRB)의 연구 승인(BTMP-2023-044) 후에 수행되었다.
결 과
술전 미생물 배양 검사 여부
술전 미생물 배양 검사가 시행된 경우는 총 14건이었으며, Methicillin resistant Staphylococcus 종류가 4건(12.12%)으로 가장 많았고, CRPA와 Proteus mirabilis가 각각 2건(6.06%), Ciprofloxacin susceptible Pseudomonas aeruginosa (CSPA)와 Coagulase-negative Staphylococcus (CoNS)가 각각 1건(3.03%)으로 뒤를 이었다. 미생물 배양 검사를 시행했으나 균주가 자라지 않은 경우는 총 4건(12.12%)이었으며, 미생물 배양 검사가 시행되지 않은 경우는 17건(51.51%)으로 확인되었다.
술후 감염 발생 후 시행한 미생물 배양 검사 및 균주의 종류
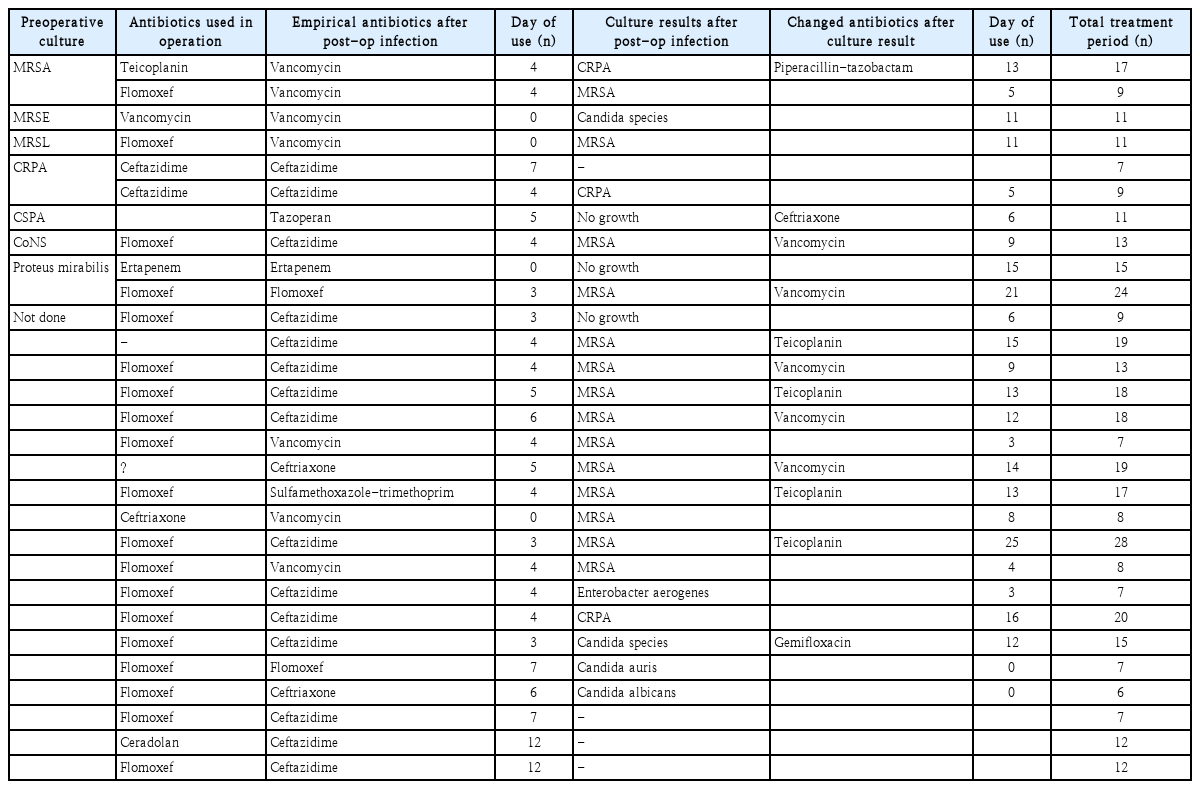
33명의 술후 감염 환자 중 29명에게서 술후 미생물 배양 검사가 시행되었다. 배양 건수 29건 중 세균이 배양된 경우는 20건, 진균이 배양된 경우는 6건이었고, 균주가 검출되지 않은 경우는 3건이었다. 4명의 환자에게서는 미생물 배양 검사 없이 경험적 항생제가 치료에 사용되었다.
균주가 배양된 26건의 검사 중 총 3가지 종의 세균과 2가지 종의 진균이 검출되었다. 이 중 MRSA 15건(45.45%), CRPA 4건(12.12%), Enterobacter 1건(0.30%) 순으로 확인되었다. 진균으로는 Candida 5건(15.15%), Aspergillus 1건(0.30%)이 확인되었다(Table 2).
또한 술전 미생물 배양 검사에서 동정된 균주와 술후 감염 후 동정된 균주가 일치했던 경우는 총 3건에 불과했다(Fig. 2).

Identified strains from preoperative and postoperative culture. The most identified strain was MRSA, and there were only three cases of the same strain identified before and after surgery. MRSA, Methicillin-resistant Staphylococcus aureus; MRSE, Methicillin-resistant Staphylococcus epidermis; MRSL, Methicillin-resistant Staphylococcus lugdunensis; CRPA, Ciprofloxacin-resistant Pseudomonas aeruginosa>; CSPA, Ciprofloxacin susceptible Pseudomonas aeruginosa; CoNS, Coagulase-negative Staphylococcus.
술후 감염 발생 시 초기 선택한 경험적 항생제
술후 감염 발생 시 초기 선택한 항생제는 ceftazidime이 16건(48.48%)로 가장 많았고, vancomycin이 9건(27.27%), flomoxef와 ceftriaxone이 각각 2건(6.06%), gemifloxacin, ertapenem, sulfamethoxazole-trimethoprim, piperacillintazobactam이 각각 1건(3.03%)씩 사용되었다(Table 3).
배양 검사 결과에 따라 변경한 2차 항생제
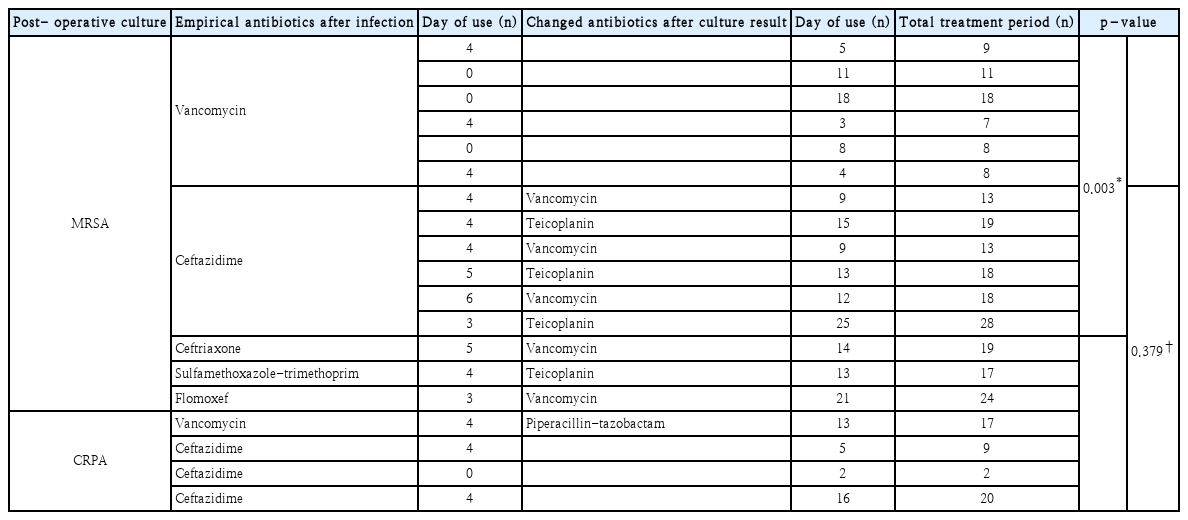
술후 감염 후 시행한 미생물 검사에서 배양된 균주가 MRSA 또는 CRPA 등 경험적 항생제에 감수성이 없는 것으로 확인된 경우에는 균주에 감수성이 있는 항생제로 변경을 시행하였으며, 이외의 균주가 동정되었을 경우에는 기존 경험적 항생제 사용을 지속하였다(Fig. 3).
술후 감염 발생 시 항생제 사용일 수
각 균주별로 항생제 치료 기간은 배양 검사에서 동정된 균주가 MRSA일 경우 총 치료 기간은 평균 15.33일이 소요되었고 CRPA는 평균 12.00일이 소요되었으며, 두 군간 통계적으로 유의미한 차이는 보이지 않았다(p=0.379) (Table 4).
또한 술후 감염 발생 후 경험적 항생제로 vancomycin을 선택했을 때의 총 치료 기간은 평균 10.67일, ceftazidime을 선택했을 때는 평균 13.06일이 소요되었으며 두 군간 통계적으로 유의미한 차이는 보이지 않았다(p=0.329) (Table 5).
마지막으로 술후 감염 발생 후 시행한 배양 검사에서 MRSA가 검출되었을 때 처음부터 경험적 항생제를 vancomycin으로 사용한 군의 총 치료 기간은 평균 10.17일로, 다른 경험적 항생제를 사용하다가 배양 검사가 나온 뒤 항생제를 vancomycin, teicoplanin으로 교체한 군의 총 치료 기간인 평균 18.78일에 비해 통계적으로 유의미하게 짧은 것으로 나타났다(p=0.003) (Table 4).
고 찰
본 연구에서 대상에 포함된 총 33명의 환자 중 배양 검사를 시행한 환자 수는 29명이었다. 이 중 대다수는 항생제 내성 균주인 MRSA, CRPA 등이 검출되었다. 6건(18.18%)에서는 진균이 검출되었고, 4건(12.12%)에서 균이 검출되지 않았다. 이처럼 이루에 대한 세균 배양이 되지 않은 이유로는 술전 항생제의 장기적인 사용으로 정균 상태가 되어 병원균의 증식 및 성장이 느려지거나, 천천히 증식하는 병인균이 감염의 원인인 경우를 생각해볼 수 있다[4].
외국의 한 연구에 따르면 만성 중이염의 재발을 일으킬 수 있는 위험 요소로는 술전 다제 내성 균주 감염 기왕력, 60세 이상의 나이, 당뇨병 등이 있다[5]. 술후 감염은 만성 중이염의 재발을 일으킬 수 있는 중요한 증상이기 때문에 본 연구에서는 환자의 연령 분포 및 기저질환에 대해서도 조사하였다. 연구에 술후 감염이 발생하지 않은 환자는 포함되지 않아 유의미한 통계적 분석은 어려웠으나, 당뇨병을 기저질환으로 가지고 있는 환자는 3명으로 비교적 적은 것을 확인할 수 있었다. 또한 60세를 기준으로 60세 이상은 17명, 60세 미만은 16명으로 비교적 고른 대비를 보였다.
2001년에서 2010년까지 약 10년간 균주 변화에 관한 국내 보고에 따르면, 만성 중이염 환자의 균주는 Methicillin-sensitive Staphylococcus aureus (MSSA) 28.5%, Pseudomonas aeruginosa 20.4%, MRSA 8.5%, CoNS 7.2% 순이었다[6]. 하지만 본 연구에서 확인한 만성 중이염 술후 감염 환자에서 시행한 균주의 발생 빈도는 MRSA, CRPA, 기타 균주 순이었으며, 57.6%가 흔히 사용하는 경험적 항생제에 대한 내성균이었다. 이는 흔히 처방되는 경구 광범위 항생제에 내성을 갖는 균이 만성 중이염에서 전체 동정되는 균의 약 37%를 차지한다는 기존에 알려진 연구에 비해 비교적 높은 수치를 보였다[3]. 또한 술전 미생물 배양 검사에서 동정된 균주와 술후 감염 후 동정된 균주가 일치했던 경우는 총 3건에 불과했던 것으로 미루어 보아 기존 연구에서 밝혀진 만성 중이염 환자의 이루에서 배양되는 균주의 순위와 술후 감염 발생을 일으키는 균주는 차이를 보이고 있음을 확인할 수 있다(Table 3). 이러한 차이의 이유로 수술 전후 동정된 균주가 일치하는 경우가 매우 적으며, 술후 감염균의 대부분이 항생제 내성균임을 고려하였을 때 기존 병원균이 잔존해 있기보다는 수술 중 감염 및 원내 감염의 가능성이 높을 것으로 생각된다.
본 연구의 대상이 된 환자군은 수술 이후 합병증 및 감염을 예방하기 위한 항생제를 사용했음에도 다시 감염이 발생한 경우로, 술후 심한 염증 소견이 있다면 항생제 내성 균주가 병인일 가능성이 높을 것으로 추론할 수 있다. 이에 연구 대상자들에게는 대체로 항생제 내성 균주에 감수성이 있는 경험적 항생제들이 주로 사용되었다. 본원에서 초기에 경험적으로 선택한 항생제는 ceftazidime이 16건(48.48%)로 가장 많았고, vancomycin이 9건(27.27%), flomoxef와 ceftriaxone이 각각 2건(6.06%), gemifloxacin, ertapenem, sulfamethoxazole-trimethoprim, piperacillin-tazobactam이 각각 1건(3.03%)씩 사용되었다. 본 연구에서 술전 배양 검사가 없는 경우 조사된 기간의 초반 및 중반에는 만성 중이염 환자에서 fluoroquinolone 이용액의 광범위한 사용으로 ciprofloxacin에 대한 내성을 지닌 Pseudomonas 증가가 보고되어 경험적 항생제로 ceftazidime을 선택하였다[7]. 하지만 경험적 항생제로 ceftazidime을 사용 중 시행된 미생물 배양 검사 결과 MRSA가 많이 동정되었기 때문에, 조사된 기간의 후반에는 균주 동정 전 vancomycin을 경험적으로 선택하였다. 본 연구 결과에 따르면 술후 감염균에서 MRSA가 15건(45.45%)으로 CRPA (12.12%)에 비해 확연히 많은 수가 동정되었다. 따라서 술후 감염 발생 시 ceftazidime보다는 1차적으로 MRSA에 높은 감수성을 가진 vancomycin, teicoplanin 등의 사용이 더 적절할 것으로 사료된다. 또한 본 연구는 술후 감염 시 감염균에 따른 치료 기간에 대한 정보를 포함하고 있어 임상적으로 큰 의미를 가질 수 있을 것으로 생각된다.
제한점
본 연구는 만성중이염 수술 후 심한 수술 후 감염으로 입원치료를 시행한 환자만을 대상으로 하였다. 따라서 술후 추적 관찰 중 경도의 술후 감염을 보이는 환자들은 제외되었기 때문에 술후 감염균에서 항생제 내성균의 비율이 높을 수 밖에 없을 것으로 생각된다. 또한 본 연구는 술후 감염으로 입원한 환자 33인에 대해서만 분석하였기 때문에 그 대상이 작아 술후 감염 전체에 적용하기에는 제한이 있다. 추후 만성중이염 수술을 시행한 전체 환자 수를 대상으로 하여 진단별, 연령별, 수술 방법에 따른 술후 감염에 대한 추가 연구가 필요할 것으로 사료된다.
결론적으로, 만성 중이염 술후 감염 발생 환자의 이루에서 배양되는 균주는 약제 내성 균주의 비율이 매우 높으며, 술전에 이루에서 배양되는 균주와 같았던 경우는 3건으로 결과가 다른 경우가 더 많음을 미루어 보았을 때, 술후 감염 발생 시에 미생물 배양 검사는 필수적이라는 것을 알 수 있다. 또한 술후 감염 시 사용할 경험적 항생제로는 MRSA에 높은 감수성을 보이는 vancomycin 또는 teicoplanin을 선택하는 것이 적절하겠으나, vancomycin은 내성 균주가 발생할 위험이 있어 초기부터 경험적 항생제로 선택하기에는 임상적으로 어려움이 있다. 따라서 다른 경험적 항생제를 사용하게 되더라도, 본 연구와 같이 MRSA가 동정될 가능성이 높음을 염두에 두고 결과가 나오는 즉시 해당 균주에 감수성을 보이는 항생제로 변경하는 것이 필요할 것으로 사료된다.
Acknowledgements
None
Notes
Author contributions
Conceptualization: Hyong-Ho Cho. Data curation: Keon-Woo Park, Dong-Eun Lee. Formal analysis: Keon-Woo Park, Dong-Eun Lee. Investigation: Keon-Woo Park, Hong Chan Kim. Methodology: Hyong-Ho Cho. Supervision: Hyong-Ho Cho, Hong Chan Kim. Validation: Keon-Woo Park. Visualization: Keon-Woo Park. Writing—original draft: Keon-Woo Park. Writing—review & editing: Hong Chan Kim, Hyong-Ho Cho.