비용종을 동반한 만성 비부비동염의 내재형(endotype)에 따른 임상상과 염색 방법에 따른 호중구성 비용종의 분류와 임상적 특징
Clinical Characteristics of Chronic Rhinosinusitis With Nasal Polyp According to Histopathological Endotypes and Staining Method for Neutrophilic Polyp Classification and Its Clinical Implication
Article information
Trans Abstract
Background and Objectives
There are various methods used to histologically assess the cell count of neutrophils in nasal polyps. With various classification of neutrophilic nasal polyps, determining the appropriate staining techniques and criteria is deemed important for the diagnosis of neutrophilic nasal polyps by assessing neutrophil cell counts. In this study, we tried to optimize different methods of neutrophil counting and staining by comparing clinical outcomes.
Subjects and Method
We studied 207 patients who underwent endoscopic sinus surgery for chronic rhinosinusitis with nasal polyp from August 2014 to September 2018. Patients’ nasal polyp were taken to make following three slide sections: hematoxylin and eosin, human neutrophil elastase (HNE), myeloperoxidase. After staining, microscope picture (×400) was taken and neutrophils were counted. Neutrophil polyp (NP) was classified either by the tissue neutrophil count (20/HPF) or by the neutrophil percentage (1%/total cell) for clinical outcome comparison.
Results
Two groups were made after HNE staining: the NP and the non-NP groups. The L-K scores and delta showed significant differences between each group while neutrophil was defined based on 20 counts/HPF (p<0.001). By Kaplan-Meier estimation, there was no statistical meaning between the two groups. But the NP group had a tendency to recur more than the non-NP group while 20 counts/HPF definition was used (p>0.05).
Conclusion
HNE staining and 20 counts/HPF were the most specific for neutrophil counting. Analyzing the nasal polyp into two groups due to histologic types showed that the NP group had worse prognosis than the non-NP group. In conclusion, neutrophils in the nasal polyp might be considered seriously for clinical outcomes.
서 론
만성 비부비동염은 적절한 내과적 치료에도 3개월 이상 치료에 반응이 없는 것으로 정의되는 질환으로 비교적 흔한 질환이다. 발병 인자로는 자연공의 폐쇄, 알레르기, 감염 또는 비감염성 염증 반응 등이 있으며, 병인과 병태생리가 명확하게 밝혀져 있지는 않지만 다양한 인자가 점막 염증을 야기하고 염증이 만성화되어 만성 비부비동염을 발생시킨다[1,2].
임상적으로 비부비동염은 크게 비용종의 동반 유무에 따라 분류할 수 있으며 조직학적으로는 비용종에 동반된 호산구의 분율에 따라 분류할 수 있다. 만성 비부비동염에 동반된 비용종은 특징적으로 결체조직이 부종사이에 산재되어 있으며 혈관이나 분비선이 산발적으로 존재한다. 상피세포는 위중층섬모상피로 주로 이루어져 있으며, 기저층은 비후되어 호산구, 호중구, 비만세포, 림프구 등 다양한 염증세포가 기질 속에 침투되어 있다[3]. 이러한 비용종의 조직학적 분류는 동서양의 인종, 환경 등에 따라 차이가 발생하며, 유럽과 미국 등의 서구권에서는 호산구성 비용종이 가장 많은 비율을 차지하고 한국을 비롯한 동아시아 지역에서는 비호산구성 비용종이 주를 보인다[4-6].
호산구성 비용종을 동반한 만성 비부비동염의 경우 수술적인 치료가 어렵고 수술 후 재발이 잦은 임상적 특징을 보인다. 반면 비호산구성 비용종은 임상적 특징에 관하여 이견이 있는 상황이며, 최근에는 만성비부비동염 환자의 비호산구성 비용종을 호중구성 비용종으로 구분하여 임상적 특성과 수술 후 경과를 관찰하고 있다. 호중구성 비용종은 조직 내 호중구의 침윤이 특징으로 주로 Th-1 면역반응과 IL-8의 과다발현이 동반되는 호중구성 염증반응에 의해 일어난다[7,8]. 또한 일반적으로 호산구성 비용종에 비하여 수술 후 좋은 경과를 보이는 것으로 알려져 있다. 이렇듯 호산구성 비용종과 호중구성 비용종을 분류하는 것은 향후 임상양상을 보는데 있어 중요하며, 조직학적 분류 작업은 비용종을 채취하여 세포학적 염색 후 호산구와 호중구의 숫자를 세는 것에서 시작된다[9-11]. Hematoxylin and eosin (H&E) 염색의 경우 가장 기본이 되는 염색법으로 다른 많은 논문에서도 택하고 있는 염색법이다[12]. 구하는 것이 쉽고 잘 알려져 있는 방법이지만 호산구와 호중구의 구분이 육안으로만 이루어진다. 그 밖에 호중구가 분비하는 염증매개체 중 하나인 human neutrophil elastase (HNE), myeloperoxidase (MPO) 염색을 통해 호중구를 확인하는 염색 방법이 대표적이다[13-15].
이에 본 연구에서는 비용종을 동반한 본원 만성비부비동염 환자에서 부비동 내시경 수술 중 비용종을 채취하여 조직학적으로 분석하였다. 우선, 비용종의 염색 방법을 달리하여 호중구의 수를 측정하였으며, 다양한 염색 방법들 중 호중구의 염색에 가장 적합한 방법을 결정하였고, 결정된 호중구 염색법을 이용하여 호중구성 비용종의 정의 두 가지를 가지고 그룹을 나누어 각 그룹의 임상적 특징을 비교해 보았다.
대상 및 방법
대 상
본 연구에서는 2014년 8월부터 2018년 9월까지 본원에서 비용종을 동반한 만성 부비동염으로 내원하여 3개월 이상의 약물치료에도 불구하고 증상의 호전을 보이지 않아 본원에서 양측 또는 일측 내시경 부비동 수술을 받은 환자를 대상으로 하였다. 총 207명의 환자에 대해 수술 중 채취한 비용종 내 세포 개수 및 분율에 따라 그룹을 분류하여 이들의 임상적 특징에 대해 후향적으로 비교 분석을 하였다. 남자 157명, 여자 50명이었으며 평균 연령은 45.5세였다. 환자들은 모두 수술 후 3개월 이상 추적 관찰된 환자들이었으며 수술 후 평균 추적 관찰 기간은 32.9개월이었다(Table 1).
본 연구는 단국대학교병원 생명윤리위원회의 승인을 받아 진행되었다(IRB No. 2019-03-014).
방 법
염색 방법
모든 수술 중 채취한 비용종을 H&E, HNE, MPO 염색을 시행하였다. H&E 염색의 경우, 10% 중성 포르말린 고정과 파라핀 포매를 거친 조직을 연속 절편으로 만들어 100% xylene으로 탈파라핀을 하고 무수알코올 90%, 75% 및 50% 에탄올에 각각 2분씩 처리하여 함수시켰다. 내인성 과산화효소의 활성을 억제하기 위해 3% 과산화수소에 1분간 처리하고 증류수로 세척하였고 hematoxyline 용액에 3분, eosin 용액에 1분간 처리하고 탈수 후 봉입하였다.
HNE (R&D Systems, MAB91671; Bio-techneⓇ, Minneapolis, MN, USA) 염색은 100% xylene으로 탈파라핀을 하고 무수알코올 90%, 75% 및 50% 에탄올에 각각 2분씩 처리하여 함수시켰다. 내인성 과산화효소의 활성을 억제하기 위해 3% 과산화수소에 10분간 처리하고 증류수로 세척한 다음 50 mM Tris 완충용액으로 수세하였다. 그 다음 비특이성 반응을 제거한 후 mouse anti-human neutrophil elastase/ELA2 monoclonal antibody를 Tris 완충 용액에 1:200으로 희석하여 4℃에서 하루 밤 동안 반응시켰다. 일차 항체 반응 후 Tris 완충용액으로 수세하고 발색제인 3, 3-diaminobenzidine tetrachloride 용액을 가하여 발색반응을 관찰하면서 5분간 반응시킨 후 봉입하였다. MPO (R&D Systems, AF3667; Bio-techneⓇ) 염색의 경우 HNE 염색과 동일한 과정을 거쳤으며, mouse anti-human myeloperoxidase/MPO monoclonal antibody를 사용하였다.
Slide 비교 및 분류
비용종은 3가지 연속된 절편(slide)으로 나누어 H&E, HNE, MPO 염색을 각각 시행하였으며, 염색 후 광학 현미경을 사용하여 slide당 3곳의 세포 밀도가 가장 높은 곳을 선정하여 400배 배율로 관찰하였다(Fig. 1). 이후 3종류의 slide 각각의 총 세포 수 및 총 호중구 개수를 염색된 방법 별로 기록하였다. 비용종은 3종류의 slide에서 호중구 개수 총 20개 이상(20 counts/HPF) 또는 호중구 비율 1% 이상(1%/total cell)을 기준으로 호중구성 비용종(neutrophilic polyp, NP)과 비호중구성 비용종(non-neutrophilic polyp, non-NP)으로 구분하여 각 분류 기준에 따른 환자의 예후를 비교해 보았다[16].
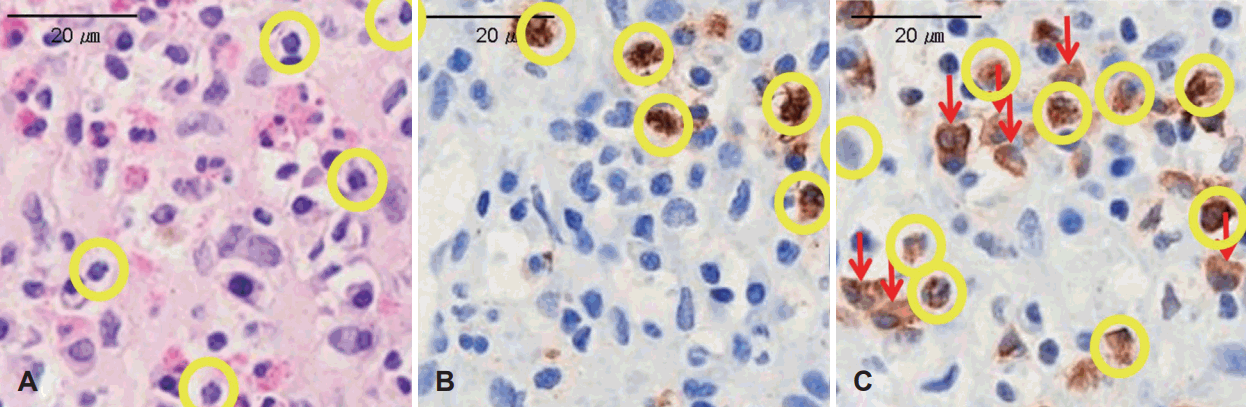
Hematoxlyn and eosin (H&E), human neutrophil elastase (HNE), myeloperoxidase (MPO) staining in nasal polyp. Neutrophils showing multilobed nucleus with cytoplasmic granules (circles). A: H&E staining of nasal polyp ×400. B: HNE staining of nasal polyp ×400. C: MPO staining of nasal polyp ×400 with unspecific stained macrophage (arrows).
수술 전, 후 비내시경 소견의 점수화
모든 환자의 수술 직전 비내시경 소견 및 수술 후 가장 최근 방문한 외래에서의 비내시경을 Lund-Kennedy endoscopic score (L-K score) 체계를 이용하여 측정하였다. 비내시경에서 우측, 좌측 비강내 discharge, polyp, edema에 대해 수술 전후로 나눠서 0, 1, 2점의 점수를 각각 측정하였다. 특히 비용종의 경우, 비용종이 없을 때를 0점, 하비갑개의 상연까지 비용종이 자란 경우 1점, 하비갑개의 하연이상 자란 경우 2점으로 분류하여 양측의 점수를 합산하여 둘의 평균으로 평가하였다[17]. 수술 후 3개월 이후 시점에 비용종의 재발이 관찰되는 경우 비용종이 재발한 것으로 판단하였다.
통계 분석
본 논문의 통계 분석에는 SPSS 18.0 (SPSS Inc., Chicago, IL, USA)을 이용하였다. 염색 방법당 측정되는 호중구성 비용종(NP) 그룹의 인원수를 분석하는데 일원배치 분산 분석 및 사후분석으로 Tukey method를 이용하였고, 염색 방법별로 바뀌는 호중구의 총 개수간 상관관계를 Pearson의 상관분석을 이용하여 비교하였다. 수술 전후의 비내시경 소견 비교를 위해서 L-K score, total 값을 가지고 수술 전후의 차이인 delta를 Mann-Whitney test를 이용하여 비교하였다. 비용종 재발율 비교를 위해서 수술 후 Lund-Kennedy score, polyp 값을 각 그룹간 비교하여 양측 비강 합계 2점 이상을 재발된 것으로 설정, Log 순위와 Kaplan-Meier 방법으로 생존분석을 하였고, 모든 그룹 간의 통계적인 유의한 차이는 p-value 0.05 미만인 경우로 선정하였다.
결 과
H&E, HNE, MPO 염색 및 상관관계 비교
총 207명의 비용종을 연속된 3개의 절편으로 만들어 각각을 H&E, HNE, MPO로 염색하여 호중구의 개수를 측정하였으며 correlation graph를 통하여 각각을 비교하였다(Figs. 1 and 2). 세 가지 염색법에 따른 호중구 개수의 평균을 비교하였을 경우 H&E에서 total count 18.01±35.20개(mean count±standard deviation), HNE에서 39.36±68.10개, MPO에서 138.14±155.61개로 나타났으며 H&E, HNE, MPO 염색법의 순서로 평균적으로 많은 수의 호중구가 발견되었다(p<0.01) (Table 2). Correlation 측면에서는 H&E와 HNE는 p<0.001, 상관계수(r)=0.56, H&E와 MPO는 p=0.046, 상관계수(r)=0.14, MPO와 HNE는 p<0.001, 상관계수(r)=0.33을 나타내어 세 가지 염색법이 모두 유의미한 상관관계를 보이며 그중 H&E와 HNE가 가장 높은 상관 계수를 보여주었다(Fig. 2).
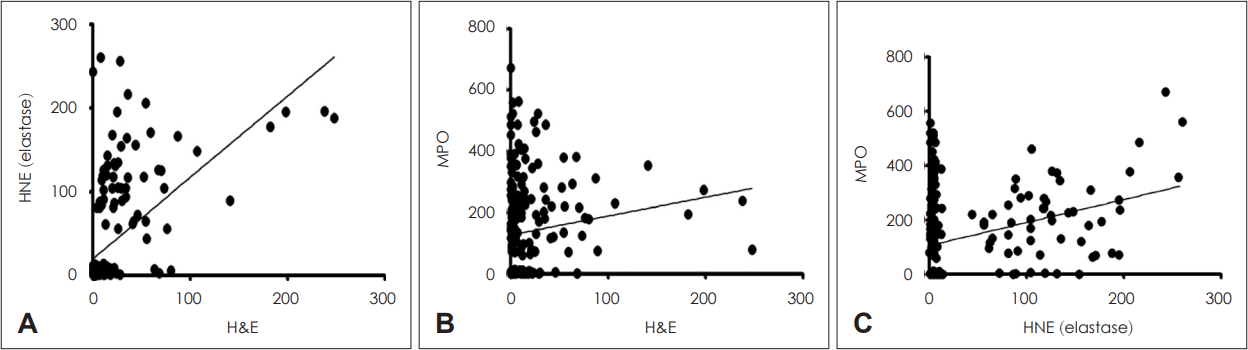
Correlation graph between three stain methods. A: Correlation of hematoxylin and eosin (H&E) verses human neutrophil elastase (HNE) stain (p<0.001, r=0.56). B: Correlation of H&E verses myeloperoxidase (MPO) (p=0.046, r=0.139). C: Correlation of HNE verses MPO (p<0.001, r=0.330).
호중구성 비용종의 조직학적 분류
HNE 염색법을 시행한 slide 세 군데에서 보이는 호중구(neutrophil) 개수 총합이 20개 초과(neutrophil ≥20/HPF) 혹은 slide 세 곳에서 보이는 호중구의 비율이 총 세포 수의 1% 이상일 경우(neutrophil ≥1%/total cell) 두 가지를 호중구성 비용종의 기준으로 하여 group을 나누었다[16]. Neutrophil ≥20/HPF의 경우 호중구성 비용종(NP)이 총 56명, neutrophil ≥1%/total cell의 기준의 경우 호중구성 비용종 환자가 총 94명으로 해당 group의 총 인원이 증가하게 되었다(p<0.01) (Table 3).
호중구성 비용종의 수술 전 후 비내시경 소견 점수화
수술 전과 후의 비내시경 L-K score의 차이인 ΔL-K score를 관찰할 경우 HNE 염색법을 사용한 neutrophil ≥20/HPF 기준에서는 호중구성 비용종이 비호중구성 비용종에 비하여 delta 값이 유의하게 낮게 나타났다(p<0.05). 반면, 동일한 염색법의 neutrophil ≥1%/total cell 기준의 경우 호중구성 비용종과 비호중구성 비용종 사이에 L-K score delta 값의 유의미한 차이는 보이지 않았다(p>0.05) (Fig. 3).
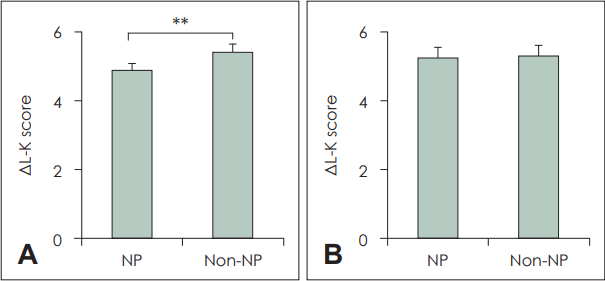
Comparison of Lund-Kennedy (L-K) score, pre op-post op (Δ) between two definition neutrophil groups. A: ΔL-K score; comparison between neutrophil polyp and non-neutrophil polyp in the definition of ≥20 neutrophils/HPF (p=0.012). B: ΔL-K score; comparison between neutrophil polyp and non-neutrophil polyp in the definition of ≥1% neutrophils/total cell (p>0.05). NP, neutrophilic polyp; ΔL-K score, pre op- post op L-K score.
호중구성 비용종의 수술 전 후 비용종 재발율
L-K score에서 polyp만을 고려한 polyp score를 가지고 수술 전과 후의 비용종 재발율을 Kaplan-Meier estimation으로 비교할 경우, HNE 염색법을 사용한 neutrophil≥20/HPF 기준에서 호중구성 비용종과 비호중구성 비용종 간에 유의미한 용종 재발율(polyp recurrence free rate)의 차이가 없었다(p<0.05). 동일한 염색법의 neutrophil ≥1%/total cell 기준의 경우에도 호중구성 비용종과 비호중구성 비용종간에 용종 재발률의 유의미한 차이가 보이지 않았다(p<0.05) (Fig. 4). 두 가지 분류 방법을 서로 비교하였을 때 통계적 유의성은 없었으나 neutrophil ≥20/HPF의 경우 좀 더 Kaplan-Meier estimation에서 호중구성 비용종이 비호중구성 비용종에 비해 재발율이 높아 보이는 경향성이 나타났다.
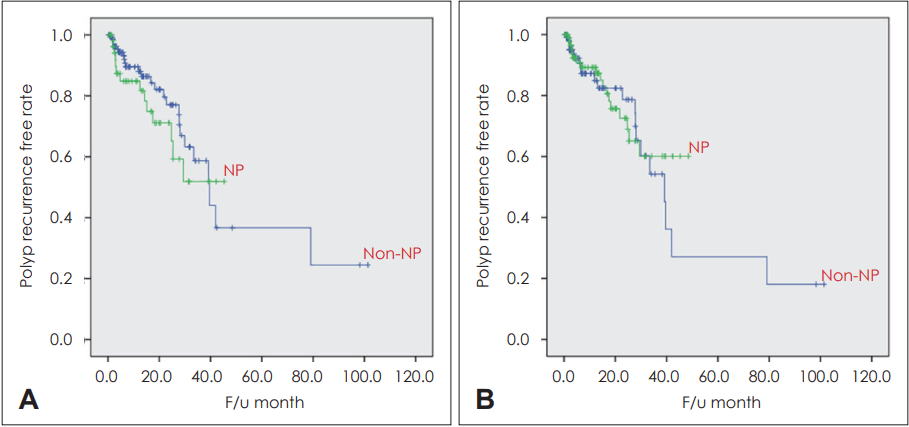
Polyp recurrence free rate in two different definition neutrophil groups using Kaplan-Meier graph. A: Polyp recurrence free rate in NP and non-NP group defined by ≥20 neutrophils/HPF (p>0.05). B: Polyp recurrence free rate in NP and non-NP group defined by ≥1% neutrophils/HPF (p>0.05). NP, neutrophilic polyp; F/u, follow-up.
고 찰
만성 비부비동염은 크게 표현형(phenotype)과 내재형(endotype)으로 구분할 수 있으며, 과거에는 표현형에 관한 연구가 활발하게 진행되어 왔었다. 표현형은 만성 비부비동염의 겉모습을 나타내는 것으로 간단한 내시경적인 관찰, 혈액 검사, 병력 청취를 통해 비용종의 존재 유무, 아스피린 과민성, 낭성섬유증 동반 유무, 감염성 비부비동염, 진균성 비부비동염 등으로 부비동염을 구분하는 것을 말한다[1]. 표현형을 구분하는 것만으로도 환자의 치료 방법 및 예후가 달라질 수 있어 표현형을 구분하는 것은 비부비동염의 중요한 진단 과정이었다. 특히 비용종을 동반한 비부비동염의 경우 항생제에 잘 듣지 않고 치료 이후에도 잦은 재발을 하는 것으로 알려져 있어 표현형에서는 비용종의 동반 유무가 비부비동염의 치료 예후에 있어 중요한 지표라고 할 수 있다[18,19]. 하지만 비용종을 동반한 비부비동염에서도 약제에 대한 치료 반응은 다양하며 손쉬운 치료가 이루어지거나, 어떠한 경우에는 약제나 수술적 치료에도 잦은 재발을 하는 보이는 모습을 보여 비용종에 대한 병리조직학적 분석을 바탕으로 비부비동염을 구분하는 내재형 구분 방식이 현재는 주 흐름을 가지고 가게 되었다.
내재형은 크게 호산구성 비용종과 비호산구성 비용종으로 나누어져 있으며, 호산구성 비용종은 비호산구성 비용종에 비해 서양인에서 호발하고 심한 주관적 증상, 치료에 늦은 반응과 높은 재발율을 보인다고 알려져 있다[20,21]. 하지만 이는 주로 서양인을 대상으로 진행한 연구로 서양인에서는 비용종의 80% 가까이가 호산구성 비용종으로 나타날 수 있는 반면에 아시아인의 경우 훨씬 못 미치는 수준으로 나타나고 있다. Kim 등[13]의 연구에 따르면 최근 2010-2011년도 비용종을 동반한 환자군에서 호산구성 비용종이 50.9%로 나타났으며 나머지 절반가량은 비호산구성 비용종으로 나타났다. Zhang 등[22]에 따르면 비호산구성 비용종의 경우 비용종조직의 호중구 침윤 정도가 도드라졌으며 이는 벨기에인을 대상으로 연구한 서양인의 비용종과 차이가 나는 점이라고 발표하였으며, 이에 Ikeda 등[16]은 호산구성 비용종과 함께 아시아인에서 호중구성 비용종의 기준값을 연구하여 호중구성 비용종의 정의를 H&E 염색을 한 상태에서 neutrophil ≥20/HPF를 기준으로 하였다. 이처럼 호중구성 비용종은 아시아인에서 많은 부분을 차지하는 비용종으로 국내에서도 연구되어 호중구성 비용종이 비호중구성 비용종에 비해 치료가 잘 되지 않고 재발이 잦을 수 있는 인자가 될 수 있음이 연구 되었다[13].
본 연구는 우선 비용종의 조직학적 분류를 원활하게 할 수 있는 방법을 찾기 위해 조직을 연속된 세 개의 슬라이드로 만들어 각각을 H&E, HNE, MPO 세 가지로 염색하여 호중구의 개수를 HPF (×400)에서 세어 보았다. H&E 염색의 경우 가장 기본이 되는 염색법으로 다른 많은 논문에서도 택하고 있는 염색법이다[12]. 구하는 것이 쉽고 잘 알려져 있는 방법이지만 호산구와 호중구의 구분이 육안으로만 이루어져 둘의 구분이 어려운 경우가 많이 나타났다. MPO의 경우에는 호중구가 갈색으로 표지되어 구분이 잘 되었으나 HNE에 비교하여 macrophage까지 비특이적으로 과염색이 이루어지는 모습이 나타났다(Fig. 1). Correlation 그래프를 비교해 보았을 때도 MPO와 비교된 다른 염색법들은 상관계수가 상대적으로 낮았으며(Fig. 2), 세 가지 염색 방법에 따른 호중구의 개수 역시 MPO가 월등히 높은 수치를 보여(Table 1) 실제로 MPO가 과하게 비특이적으로 호중구 염색을 하는 것으로 생각할 수 있었다. 호중구, 호산구, macrophage에는 모두 과립에 peroxidase를 가지고 있으며 이곳에 MPO가 비특이적으로 염색이 일어나 발생할 수 있는 현상으로 생각되며, 위의 결과를 바탕으로 생각해 보았을 때 HNE를 이용하는 것이 호중구를 구분할 수 있는 시인성이 좋고 비특이적 염색이 적어 가장 적절할 염색법으로 생각되어진다.
호중구성 비용종의 정의에 관하여는 HNE 염색법으로 세포 수 측정을 완료한 상태에서 neutrophil ≥20/HPF와 neutrophil ≥1%/total cell 두 가지를 적용하여 207명의 환자군을 구분하였으며, neutrophil ≥1%/total cell을 기준으로 하였을 경우 호중구성 비용종에 해당하는 환자 군이 56명에서 94명으로 2배 가까이 증가하게 되었다(Table 3). 이후 두 가지 정의를 기준으로 ΔL-K score를 비교하였으며, neutrophil ≥20/HPF 기준의 경우 호중구성 비용종(NP)이 비호중구성 비용종(non-NP)에 비해 수술 전후 L-K score의 차이가 적게 나는 것으로 확인되어 수술 이후 예후가 불량함을 알 수 있었으며(p<0.01), 이는 이전 호중구성 비용종의 불량한 예후를 나타내는 이전 연구 결과들과 일치하는 모습이었다(Fig. 3) [23-26]. 끝으로 Kaplan-Meier estimation을 이용한 비용종의 재발율은 두 가지 기준에 따른 호중구성 비용종과 비호중구성 비용종 간 유의미한 차이가 나타나지 않았지만, neutrophil ≥20/HPF 기준의 경우 좀 더 호중구성 비용종의 수술 후 재발이 잘 나타나는 경향성을 보였다(Fig. 4). 이를 바탕으로 생각해 볼 때 두 가지의 기준 중 neutrophil ≥20/HPF의 기준이 수술 이후 호중구성 비용종의 나쁜 예후를 잘 나타내어 주고 있어 기존의 연구와 부합되는 결과를 보였다. neutrophil ≥1%/total cell의 경우 호중구의 개수를 세어보는 것 외에도 전체 세포 수를 따로 집계해야 하며 슬라이드에서 가장 호중구의 분포가 풍부한 곳을 고르는 작업 역시 시술자의 주관이 들어 갈 수 있어 호중구성 비용종의 군을 선정하는데 부적합한 방법으로 생각된다.
본 연구는 잘 알려지지 않은 비용종에서의 neutrophil 염색법에 대한 연구를 진행한 것으로, 선택한 염색법인 HNE의 방법을 이용 및 호중구성 비용종을 ≥20/HPF로 정의하여 실험을 진행한 결과 호중구성 비용종이 비호중구성 비용종보다 수술 이후 불량한 예후와 재발성이 나타날 수 있음이 검증되었다. 하지만 본 연구의 cell count는 연구자 1명이 단독 진행되어 cell count의 정확도가 떨어질 수 있으며, 호산구의 측정이 없는 상황에서 시행한 재발률에 대한 조사 등은 객관성이 떨어질 수 있다. 호중구성 비용종 단독에 대한 연구는 최근 활발히 진행된 것으로 아시아인에서도 50% 가량 발생할 수 있는 호산구성 비용종에 대한 고려가 같이 이루어진 연구 결과가 아니다. 따라서 HNE 염색법과 neutrophil ≥ 20/HPF의 기준을 가지고 호산구성 비용종을 임상 환자 군을 분류하여 이에 따른 임상양상에 대한 추가적인 연구가 필요하다고 볼 수 있겠다.
결론적으로, 본 연구에서는 만성비부비동염 환자의 비용종을 채취하여 조직학적으로 서로 다른 염색법을 적용해 호중구의 수를 측정하여 그중 호중구 염색에 가장 적합한 방법을 알아보았다. 또한, 결정된 호중구 염색법을 이용하여 호중구성 비용종을 두 가지 분류법으로 그룹을 달리하여 임상적 특징을 비교해 보았다.
H&E, HNE, MPO 세 가지 염색법 중 HNE의 경우, 호중구 특이적으로 염색이 이루어졌으며 호중구만 갈색으로 염색이 되어 시인성이 좋게 나타났다. 호중구성 비용종의 정의는 크게 neutrophil ≥20/HPF, neutrophil ≥1%/total cell 두 가지가 있으며 neutrophil ≥20/HPF를 선택했을 때 호중구성 비용종이 비호중구성 비용종에 비해 수술 이후 예후가 좋지 않은 기존의 연구 결과들을 충족하여 호중구의 총 개수를 가지고 정의하는 것이 옳다고 판단된다.
Acknowledgements
This research was supported by the Basic Science Research Program through the National Research Foundation of Korea (NRF), funded by the Ministry of Education [2021R1I1A1A01052298]. This research was supported by a grant of the Korea Health Technology R&D Project through the Korea Health Industry Development Institute (KHIDI), funded by the Ministry of Health & Welfare, Republic of Korea (grant number: HI22C0612).
This research was also supported by the Bio&Medical Technology Development Program of the National Research Foundation (NRF) funded by the Korean government (MSIT) (RS-2023-00220408).
This research was supported by Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Science, ICT & Future Planning (2020R1A2C1012105).
Notes
Author contributions
Conceptualization: Ji-Hun Mo. Data curation: Kwang Hyun Byun. Formal analysis: Kwang Hyun Byun. Funding acquisition: Shin Hyuk Yoo, Ji-Hun Mo. Investigation: Hyoyeon Kim, Shin Hyuk Yoo. Methodology: Shin Hyuk Yoo, Ji-Hun Mo. Project administration: Shin Hyuk Yoo, Ji-Hun Mo. Resources: Shin Hyuk Yoo, Ji-Hun Mo. Software: Shin Hyuk Yoo, Ji-Hun Mo. Supervision: Shin Hyuk Yoo, Ji-Hun Mo. Validation: Shin Hyuk Yoo, Ji-Hun Mo. Visualization: Hyoyeon Kim, Shin Hyuk Yoo, Ji-Hun Mo. Writing—original draft: Kwang Hyun Byun, Shin Hyuk Yoo. Writing—review & editing: Shin Hyuk Yoo, Ji-Hun Mo.



