폐쇄성 수면무호흡증과 만성 어지럼의 연관성: 국민건강영양조사 2019-2021
Association Between Obstructive Sleep Apnea and Chronic Dizziness: Results of the Korean National Health and Nutrition Examination Survey 2019–2021
Article information
Trans Abstract
Background and Objectives
The present study was aimed to investigate whether chronic dizziness is associated with obstructive sleep apnea (OSA) in Korean adults.
Subjects and Method
We analyzed data from the 2019-2021 Korea National Health and Nutrition Examination Survey and enrolled 2323 participants over the age of 40 who completed the sleep health and dizziness survey. Participants were assessed for the risk of OSA using the STOP-Bang questionnaire and then classified into three groups: low-, intermediate-, and high-risk. Logistic regression analyses were used to identify the relationship between chronic dizziness and OSA.
Results
The intermediate-, high-, and intermediate/high-risk groups comprised older participants with a higher proportion of male and higher body mass index compared to the lowrisk groups (all p<0.001). They also had higher rates of current smoking, high-risk alcohol consumption, hearing loss, and a higher prevalence of anemia, stroke, hypertension, diabetes, and dyslipidemia. The risk of chronic dizziness was significantly associated with the severity of OSA. Compared to the low-risk OSA group, the risk of chronic dizziness was significantly higher in the intermediate- (odds ratio [OR] 2.096; 95% confidence interval [CI] 1.507-2.913), high- (OR 2.119; 95% CI 1.013-4.434), and intermediate/high risk OSA groups (OR 2.097; 95% CI 1.508-2.917) after adjusting for the relevant variables.
Conclusion
These findings suggest that early detection and intervention of OSA may be necessary to prevent the worsening of chronic dizziness in adults.
서 론
폐쇄성 수면무호흡증(obstructive sleep apnea, OSA)은 상기도의 반복적인 완전 또는 부분적 허탈로 혈중 산소 포화도 감소를 초래하는 수면 관련 호흡 장애이다. OSA는 비교적 흔한 수면 질환으로 4%-6% 정도의 유병률을 보이며[1], 국내 연구에서도 성인 남성의 4.5%, 여성의 3.2% 정도로 보고된 바 있다[2]. OSA는 코골이, 저호흡 또는 무호흡, 각성반응, 수면 중 뒤척임, 수면 유지 불면증, 야간 배뇨 등의 수면 중 증상 외에도 주간기면, 피로감, 집중력 및 기억력 저하, 우울 증상 등 다양한 주간 증상을 초래할 수 있다.
OSA는 심혈관, 뇌혈관, 내분비, 인지장애와 같은 정신신경학적 질환, 전정질환 등 다양한 질환의 위험인자이자 연관성을 가지는 것으로 알려져 있다[3]. 다양한 질환과의 연관 기전은 정확히 알려져 있지 않지만 반복적인 저산소증에 의한 산화 스트레스, 염증반응 증가, 자율신경계 변화, 응고 항진 및 대사 조절 장애 등이 역할을 하는 것으로 알려져 있다[4].
어지럼증은 병원을 찾게 되는 가장 흔한 증상의 하나로 17%-39% 정도의 유병률을 가지며, 다양한 질환에 의해 발현 혹은 동반된다[5]. 많은 OSA 환자가 어지럼증을 호소하며, OSA와 어지럼증의 연관성 또한 다수의 연구에서 보고되고 있다. Maas 등[6]은 어지럼증을 호소하는 704명의 환자에서 STOP-Bang 설문으로 OSA 위험도를 확인한 결과, 약 20%가 OSA의 고위험군으로 확인되었으며, 저위험군과 비교하여 고위험군에서 Dizziness Handicap Inventory로 확인한 주관적 어지럼 정도가 높아 어지럼증과 OSA의 상관관계를 입증하였다. 하지만 56명의 OSA 환자를 대상으로 수면다원검사결과 지표와 두부충동검사 결과의 연관성을 분석한 Birk 등[7]의 연구에 의하면 유의미한 연관성은 확인되지 않았다. 이러한 이전 연구의 일관되지 않은 결과는 연구마다 다른 OSA의 정의와 제한된 표본 크기 때문이라고 할 수 있다. 뿐만 아니라 고혈압, 당뇨, 뇌졸중 등 OSA와 어지럼증의 다른 동반 질환과의 연관성으로 둘의 상관 관계를 입증하기 위해서는 대규모 인구 집단 기반의 연구가 필요하다. 건강보험 데이터를 이용한 코호트 분석을 통한 OSA와 어지럼증의 연관성은 국외 연구에서 보고된 바 있으나[8], 국내의 보고는 아직 부족하다.
국민건강영양조사(Korea National Health and Nutrition Examination Survey)는 1998년부터 시행된 국민의 건강행태, 만성질환 유병현황, 식품 및 영양섭취 실태에 관한 법정 조사이다. 2019년 시작된 제8기 조사에서 OSA 선별평가 항목이 처음 도입됨에 따라 본 연구는 국민건강영양조사 데이터베이스를 기반으로 한국인의 OSA와 어지럼의 연관성을 입증하고자 하였다.
대상 및 방법
연구 대상
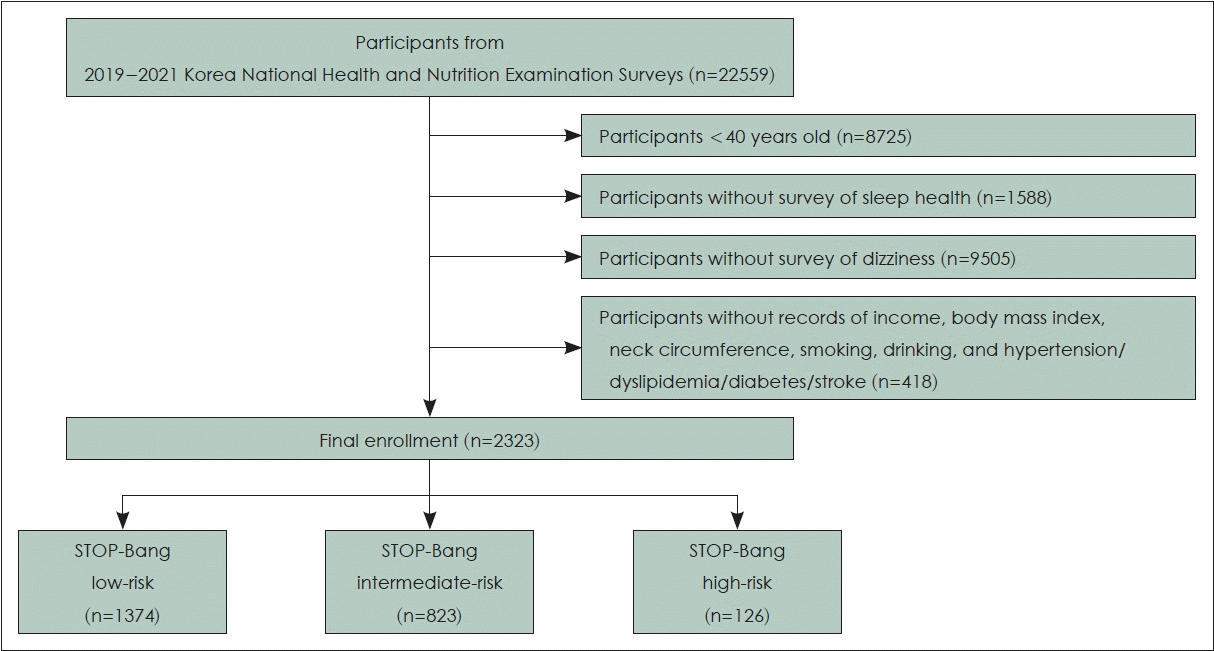
본 연구는 제8기 국민건강영양조사 원시 자료를 이용하여 후향적으로 분석하였다. 2019-2021년 시행한 제8기 국민건강영양조사에 참여한 총 22559명의 대상자 중에서 40세 미만의 대상자, 수면 건강 및 어지럼 설문조사에 응답하지 않은 대상자, 인구통계학적 정보 및 동반질환 변수의 결측값이 있는 대상자를 제외하여 총 2323명을 대상으로 분석하였다(Fig. 1).
국민건강영양조사는 질병관리청 연구윤리심의위원회 승인(2018-01-03-C-A, 2018-01-03-2C-A, 2018-01-03-3C-A)을 받아 수행되었고, 본 연구는 이차자료분석 연구로 한국원자력의학원 원자력병원 생명윤리위원회 승인(IRB No. KIRAMS-2023-05-005)을 받은 후 실시하였다.
분석 변수
국민건강영양조사에서 수집된 자료 중 만성 어지럼증과 연관된 인구통계학적 요인, 건강행태 요인, 검진조사 요인들을 고려하였다. 인구통계학적 요인으로는 성별, 연령, 가구소득 사분위를 고려하였다. 가구소득 사분위는 가구별 총소득을 조사한 뒤 월평균 가구균등화소득으로 변환하여, 이를 다시 하위, 중하위, 중상위 및 상위와 같이 사분위로 구분하였다. 건강행태 요인으로는 흡연, 음주, 스트레스 인지율을 고려하였다. 현재 흡연여부는 평생 일반담배 5갑(100개비) 이상 피웠고, 현재 일반담배를 피우는 자로 정의하였으며, 고위험 음주여부는 1회 평균 음주량이 남자의 경우 7잔 이상, 여자의 경우 5잔 이상이며 주 2회 이상 음주하는 자로 정의하였다. 스트레스 인지율은 ‘평소 일상생활 중에 스트레스를 어느 정도 느끼고 있습니까?’라는 질문에 대단히 많이 또는 많이 느끼는 편이라고 응답한 자를 높은 스트레스 인지율로, 조금 느끼는 편 또는 거의 느끼지 않는 편이라고 응답한 자를 낮은 스트레스 인지율로 구분하여 분석을 실시하였다. 검진조사 요인으로는 비만, 고혈압, 당뇨병, 고콜레스테롤혈증, 빈혈, 뇌졸중 및 난청 유병여부를 고려하였다. 비만은 체질량지수 (kg/m2)를 기준으로 저체중(<18.8 kg/m2), 정상(≥18.5 and <23 kg/m2), 비만전단계(≥23 and <25 kg/m2), 1단계 비만(≥25 and <30 kg/m2), 2단계 비만(≥30 kg/m2)으로 정의하였다[9]. 고혈압은 수축기 혈압이 140 mm Hg 이상 또는 이완기 혈압이 90 mm Hg 이상이거나 고혈압 약물을 복용한 자로 정의하였으며, 당뇨병은 공복혈당이 126 mg/dL 이상이거나 당화혈색소가 6.5% 이상 또는 의사진단을 받고 혈당강하제를 복용하고 있거나 인슐린 주사를 사용하고 있는 자로 정의하였다. 고콜레스테롤혈증은 총콜레스테롤이 240 mg/dL 이상이거나 콜레스테롤강하제를 복용하고 있는 자로, 빈혈은 헤모글로빈(g/dL)이 여성은 12 미만, 남성은 13 미만에 해당하는 자로 정의하였다. 마지막으로 뇌졸중 유무는 의사에 의해 진단받은 이력이 있는 경우로, 난청 유병여부는 일측 또는 양측의 순음청력평균(500, 1000, 2000, 4000 Hz)이 41 dB 이상의 중등도 이상의 난청이 있는 자로 정의하였다.
OSA 위험 평가
OSA의 선별도구로 4개의 설문 문항과 4개의 객관적 측정으로 구성된 STOP-Bang 설문지를 사용하였다. 코골이, 피곤함, 수면무호흡 목격자, 고혈압, 남성, 체질량지수 >35 kg/m2, 나이 >50세, 목둘레 >40 cm의 8가지 항목에 대하여 각 1점을 부여하여 평가하며 5점 이상일 경우 OSA의 고위험군, 3-4점인 경우 중위험군, 2점 이하인 경우 저위험군으로 정의하였다.
어지럼증 설문
이비인후과 검사 설문을 통해 최근 12개월 이내 어지럼증이나 균형감의 이상 경험 유무를 조사하였으며, 이에 경험이 있다고 응답한 대상자는 3개월 이상의 서있는 자세 유지의 어려움, 걷기의 어려움, 넘어진 경험, 그리고 만성적 어지럼증 유무를 추가적으로 조사하였다. 이에 만성적 어지럼증 경험 유무에 긍정적으로 응답한 자를 만성 어지럼군으로 정의하였다.
통계 분석
모든 통계 분석은 SPSS Statistics 22 (IBM Corp., Armonk, NY, USA)를 사용하여 수행되었으며, p<0.05일 때 통계적으로 유의하다고 평가하였다. 국민건강영양조사에서 권장하는 통합 가중치, 층화변수, 집락변수를 지정하여 분석하였다. 대상자의 일반적 특성, 건강관련 변수에 대해 복합표본 빈도분석과 기술통계를 이용하여 가중치를 반영하지 않은 빈도와, 가중치를 반영한 가중 퍼센트, 평균과 표준오차를 산출하였다. OSA 위험도에 따른 세 그룹 간의 일반적 특성 및 건강관련 변수의 차이는 분산 분석(analysis of variance) 또는 RaoScott χ2 test를 이용하여 분석하였다. 또한 저위험군 및 중-고위험군 두 그룹 간의 비교와 만성 어지럼군과 대조군 간의 비교를 위해서 t-test 또는 Rao-Scott χ2 test를 이용하였다. 만성 어지럼과 OSA 위험도의 연관성은 logistic regression analysis로 분석하였으며 우선 나이, 성별, 체질량지수를 보정하여 분석하였다(model 1). Model 2는 model 1에 추가적으로 흡연, 음주, 난청, 스트레스 인지율을 보정하였으며 마지막으로 다른 동반질환 여부를 보정(model 3)하여 분석하였다.
결 과
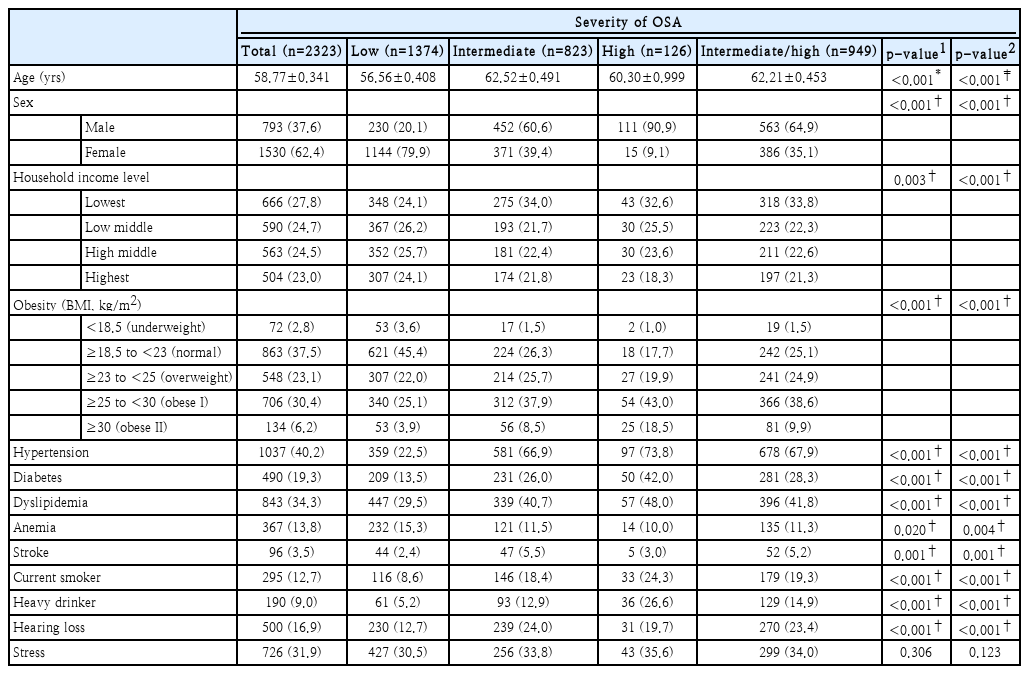
793명(37.6%)의 남성과 1530명(62.4%)의 여성을 포함하여 총 2323명을 대상으로 분석하였으며, STOP-Bang 점수에 따라 1374명(60.9%)의 저위험군, 823명(33.4%)의 중위험군, 126명(5.6%)의 고위험군으로 분류되었다. OSA의 중-고위험군은 연구 대상자의 39.1%였다. OSA 위험도에 따른 그룹별 특성은 Table 1에 제시하였다. OSA에 대한 중위험군, 고위험군 및 중-고위험군은 저위험군에 비하여 유의하게 나이가 많으며, 남성의 비율이 높고 체질량지수가 더 높음을 알 수 있다(all p<0.001). 또한 고혈압, 당뇨병, 고콜레스테롤혈증 모두 중위험군, 고위험군, 중-고위험군이 저위험군에 비하여 유의하게 유병률이 높았다(all p<0.001). 빈혈과 뇌졸중 유병률도 그룹 간 유의한 차이를 보였으나, 빈혈의 경우 OSA 저위험군의 유병률이 더 높았다. 이 외에도 현재 흡연율, 고위험 음주율, 중등도 이상의 난청율 모두 OSA 저위험군과 비교하여 중위험군, 고위험군, 그리고 중-고위험군에서 유의하게 높았다(all p<0.001). 스트레스 인지율의 경우 OSA 위험도 증가에 따라 증가하는 경향을 보였지만 통계적으로 유의한 차이는 없었다.
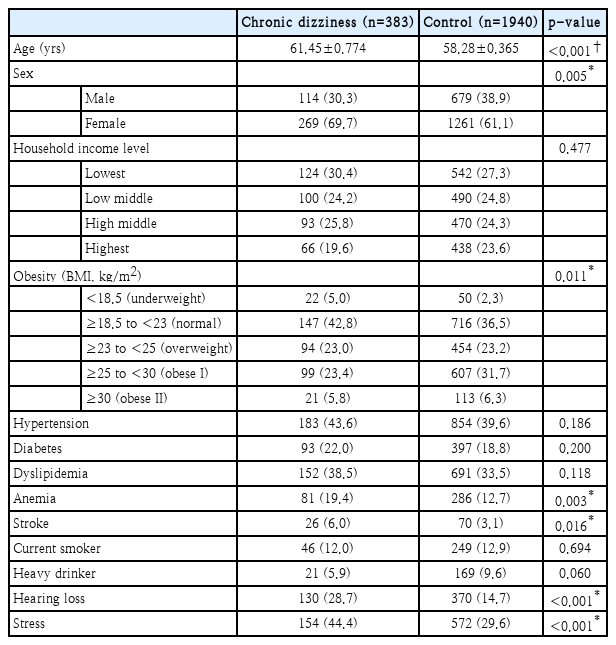
대상자의 어지럼증 설문에 대한 결과는 Table 2에 제시하였다. 연구 대상자 모두 최근 12개월 이내 어지럼증이나 균형감각 이상을 경험한 적이 있었다. 3개월 이내 서있는 자세의 유지 및 걷기의 불편함 경험도 OSA 저위험군과 비교하여 중위험군, 중-고위험군이 높아 유의미한 차이를 보였다. 그러나, 낙상 등 넘어진 경험에 있어서는 그룹 간 유의미한 차이를 보이지 않았다. 만성적 어지럼증을 호소한 대상자는 총 383명(15.4%)이었다. OSA 위험도에 따라 저위험군 199명(13.5%), 중위험군 167명(19.2%), 고위험군 17명(14.1%)으로 OSA 저위험군과 비교하여 중위험군, 중-고위험군에서 만성 어지럼 유병률이 유의하게 높았다. Table 3에서는 연구 대상자 중 만성 어지럼군과 대조군의 기본 특성을 제시하였다. 만성 어지럼군이 대조군에 비하여 고령(p<0.001)이며, 여성의 비율이 높고(p=0.005), 체질량지수가 낮았다(p=0.011). 또한 만성 어지럼군에서 빈혈(p=0.003), 뇌졸중(p=0.016), 중등도 이상의 난청 유병률(p<0.001) 및 스트레스 인지율(p<0.001)이 대조군에 비하여 유의하게 높았다.
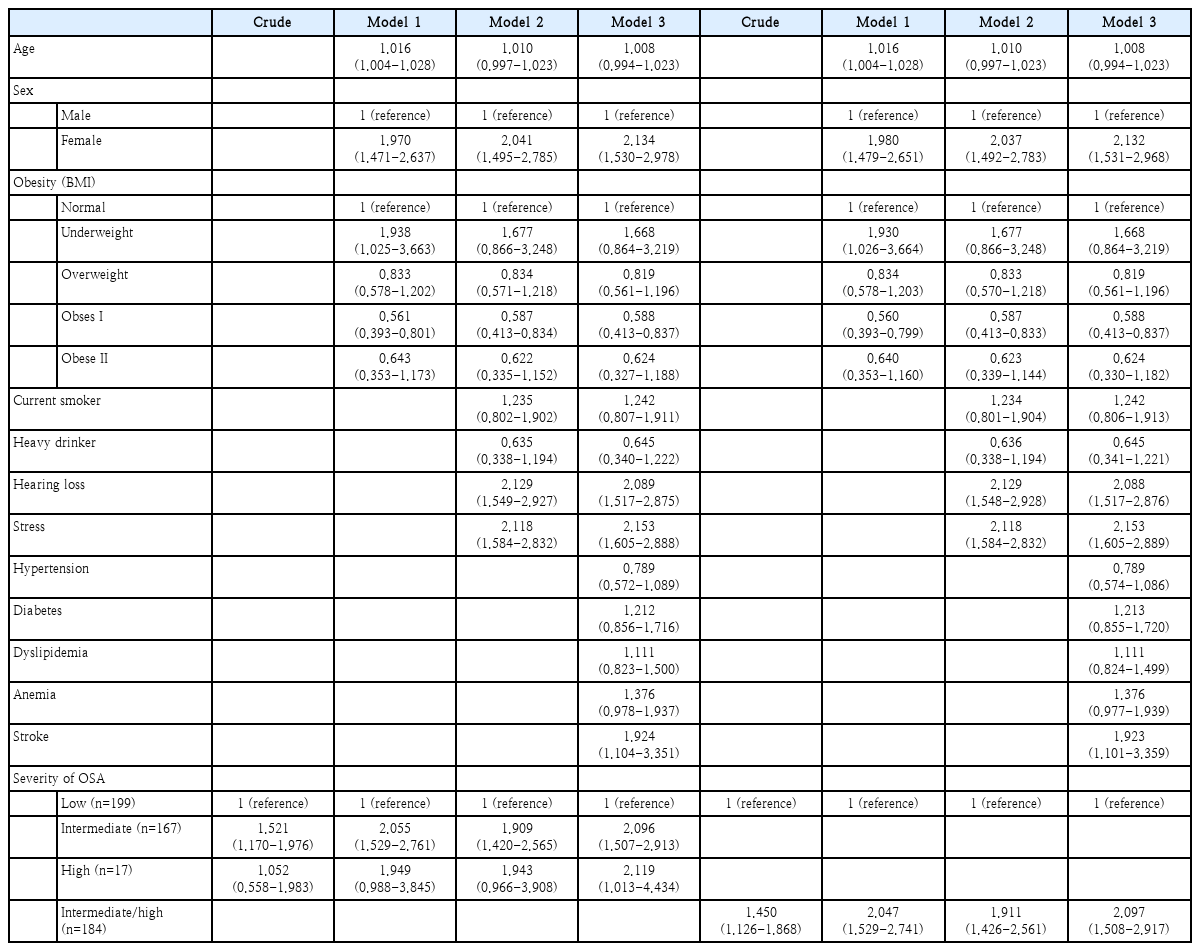
만성 어지럼증과 OSA 위험도 간의 연관성 분석 결과를 Table 4에 제시하였다. 여성에서 만성 어지럼증 발생률이 높았으며(odds ratio [OR] 2.134; 95% confidence interval [CI] 1.530-2.978), 체질량지수가 1단계 비만인 경우 만성 어지럼 발생률이 유의하게 낮았다(OR 0.588; 95% CI 0.413-0.837). 또한 중등도 이상의 난청(OR 2.089; 95% CI 1.517-2.875), 높은 스트레스 인지율(OR 2.153; 95% CI 1.605-2.888), 뇌졸중(OR 1.924; 95% CI 1.104-3.351)이 만성 어지럼과 유의한 상관 관계를 보였다. 만성 어지럼증과 연관을 보이는 이러한 변수들을 보정한 후(model 3), OSA 저위험군과 비교하여 중위험군, 고위험군에서 만성 어지럼증 발생이 유의하게 더 높았다(OR 2.096; CI 1.507-2.913 for intermediate-risk group, OR 2.119; CI 1.013-4.434 for high-risk group). 상대적으로 작은 OSA 고위험군의 표본 크기를 고려하여 만성 어지럼증 발생과 OSA 위험도간 연관성을 저위험군 및 중-고위험군 두 그룹으로 나누어서 추가 분석하였다. 만성 어지럼증과 여성(OR 2.132; 95% CI 1.531-2.968), 1단계 비만의 체질량지수(OR 0.588; 95% CI 0.413-0.837), 중등도 이상의 난청(OR 2.088; 95% CI 1.517-2.876), 높은 스트레스 인지율(OR 2.153; 95% CI 1.605-2.889), 뇌졸중(OR 1.923; 95% CI 1.101-3.359)이 유의한 연관성을 보였으며 연관 변수들의 보정 이후에도 OSA 저위험군과 비교하여 중-고위험군에서 만성 어지럼증 발생이 유의하게 높았다(OR 2.097; CI 1.508-2.917).
고 찰
본 연구에서는 국민건강영양조사 원시자료를 이용하여 한국인의 OSA 위험도와 만성 어지럼증 발생의 연관성을 확인하였다. STOP-Bang 설문을 바탕으로 OSA 저위험군, 중위험군, 그리고 고위험군으로 분류된 대상자는 나이, 성별뿐만 아니라 동반 질환의 유병률에서 그룹간 유의한 차이를 보였다. OSA 위험도에 따른 만성 어지럼 유병률은 저위험군과 비교하여 중위험군, 중-고위험군에서 유의하게 높았다. 건강 행태 요인 및 동반질환을 고려한 후에도 OSA 저위험군과 비교하여 중위험군, 고위험군, 중-고위험군에서 만성 어지럼 발생이 2배 이상으로 유의하게 높아 OSA 위험도 증가에 따른 어지럼증 발생의 증가를 확인하였다.
OSA 환자에서의 어지럼 유병률에 대한 데이터는 충분하지 않다. 대만에서 시행된 전국 코호트 연구에서 OSA 환자의 1, 5, 8년 현훈(vertigo) 누적발생률은 각각 1.2%, 5.0%, 7.4%였다[8]. 본 연구 결과에서는 2323명의 모든 대상자가 1년 이내에 어지럼증이나 균형 감각의 이상을 경험한 적이 있으며, 15.4%의 대상자에서는 만성적 어지럼증을 호소하였다. 또한 서있는 자세 및 걷기 자세 유지의 불편감에서는 4%-5% 정도의 유병률을 보였다. 본 연구에서 유병률이 더 높게 나타난 것은 건강보험데이터를 바탕으로 OSA 환자군을 정의한 대만의 사전 연구와 다르게 본 연구에서는 OSA 위험도 설문을 통해 대상자를 정의하였기 때문에 저위험군에서 OSA가 아닌 환자가 포함되었을 가능성이 있을 것이다. 또한 어지럼증을 대만 연구에서는 현훈의 발생으로 정의한 반면, 본 연구에서는 광의의 어지럼증 개념을 사용하였기 때문에 더 높은 유병률을 보였을 것이라 생각된다.
OSA 환자에서 어지럼증은 대만의 전국 코호트 연구에서 여성에서 유의하게 높은 발생률을 보였다[8]. 또한 Chen 등[10]의 어지럼을 동반한 OSA 환자의 특성을 분석한 연구에 의하면, 171명의 OSA 환자에서 어지럼을 동반한 환자군이 그렇지 않은 환자군과 비교하여 여성, 고령의 비중이 높았다. 또한 한국의 건강보험데이터를 이용한 OSA 환자에서 말초성 현훈의 위험인자를 분석한 Byun 등[11]의 연구에 의하면, 여성 및 고령이 현훈과 유의한 연관성을 보였다. 본 연구에서도 OSA 질환의 상대적으로 높은 남성 유병률에도 불구하고, 만성 어지럼증 발생 위험도는 여성에서 약 2배 이상 높아 사전 연구와 일치하는 결과를 보였다. 그러나 나이가 만성 어지럼증과 양의 상관 관계를 보이나 통계적 유의성은 확인되지 않았다.
비만은 고혈압, 당뇨, 이상지질혈증, 뇌졸중, 근골격계 질환 등 많은 만성 질환의 위험인자로 알려져 있다. 그러나 어지럼증에 대한 체질량지수의 영향은 증상의 지속 기간, 자세 불균형의 공존 등 어지럼증에 대한 연구간의 다른 정의로 인해일치하지 않는 결과를 보인다. 317명의 어지럼군과 997명의 비어지럼군을 대상으로 어지럼증과 연관된 건강행태 요인 및 동반질환의 유병률을 비교 분석한 Ray 등[12]의 연구에 의하면 비어지럼군과 비교하여 어지럼군의 체질량지수가 더 높았다. 하지만 어지럼 환자의 동반 질환을 분석한 독일의 코호트 분석에 의하면 어지럼군의 체질량지수가 정상이거나 과체중이 가장 많았으며 비만인 경우는 약 13.7% 정도였다[13]. 본 연구의 결과에서도 정상 체중과 비교하여 체질량지수 25 이상, 30 미만의 1단계 비만이 만성 어지럼의 낮은 발생률과 유의한 연관성을 보였다. 이러한 현상은 ‘비만 역설(obese paradox)’로 설명되곤 한다[14]. 다양한 만성 질환의 위험 요소인 비만이 오히려 만성 질환으로 인한 사망률에 대하여 보호 효과를 보인다는 것이다. 과도한 비만은 자세 불안정 또는 낙상 등의 위험인자가 되지만 과체중이나 가벼운 비만은 균형 조절에 긍정적인 영향을 미칠 수 있다고 생각된다[15].
OSA와 난청의 유의한 연관성은 사전 연구들을 통해 증명되었다. OSA와 난청의 연관성에 대한 메타분석 결과에 의하면[16], OSA군이 non-OSA군과 비교하여 중간 주파수 및 고주파수에서의 순음청력역치가 유의하게 높았다. 또한 평균 고주파수 청력 역치의 차이가 중간 주파수 청력 역치의 차이보다 더 크게 나타나 만성 소음 노출(코골이)로 인한 음향 외상이 난청의 잠재적 원인일 수 있음을 설명하였다. 그러나 OSA와 난청의 연관 기전은 OSA의 반복성 저산소혈증으로 인한 달팽이관의 허혈성 손상이 가장 널리 알려진 가설이며, 이는 OSA와 어지럼의 연관 기전과 동일하다고 할 수 있다. 본 연구에서도 중등도 이상의 난청이 만성 어지럼증 발생과 유의한 상관관계를 보였다.
OSA에서 어지럼이 유발되는 기전은 다양하게 제시된다. 말초 전정기능의 저하, 자율신경계의 변화, 그리고 다양한 동반 질환에 의해 어지럼이 유발될 수 있으며 이러한 기전은 반복적으로 발생하는 저산소증이 주된 역할을 하는 것으로 생각된다[4]. OSA 에서 말초 전정기능의 저하는 온도안진검사, 두부충동검사, 비디오안진검사, 전정유발근전위 검사 등 다양한 객관적 전정기능검사를 통해 이전 연구에서 분석되었다. Kayabasi 등[17]은 성별, 연령을 매치한 중등도 이상의 OSA 환자군에서 경도의 OSA 환자군과 비교하여 온도안진검사 결과 반고리관 마비(canal paresis) 비율이 유의하게 높음을 확인하였다. 또한 Xu 등[18]의 최근 연구에 의하면 OSA군에서 대조군과 비교하여 안구 전정유발근전위검사 결과에서 이상 비율이 유의하게 높았으며, N1-P1 파형의 유의한 잠복기 연장, 진폭 저하의 소견을 보여 OSA군의 이석기관 기능의 저하를 입증하였다. 이석기관은 측부순환(collateral circulation) 발달이 부족한 말단 동맥인 미로동맥(labyrinth artery)의 전정 분지의 혈액 공급에 의존하기 때문에 OSA에 의한 반복적인 저산소증과 허혈은 이석기관의 기능 저하를 초래할 것이라고 주장하였다.
OSA에서 자율신경계의 변화 또한 여러 연구를 통해 밝혀졌다. 반복되는 무호흡과 재호흡은 부교감신경과 교감신경의 활성의 반복을 초래하게 되고 결과적으로 교감신경부전 또는 과활성화를 초래하게 된다[19,20]. 이러한 자율신경계의 변화가 어지럼증과 직접적인 연관성을 가지는지는 아직 입증되지 않았으나, 만성 어지럼증 환자군에서 교감신경부전이 관찰됨[21]에 따라 연관성을 추측해 볼 수 있다.
본 연구의 강점은 OSA 위험도와 만성 어지럼 발생의 연관성을 분석하기 충분한 표본 크기와 통계적 검정력을 가지는 대규모 인구 집단 기반의 데이터베이스를 이용한 분석이라는 점이다. 그러나 본 연구에서 몇 가지 한계점을 가지고 있다. 첫째, OSA 환자군을 표준검사인 수면다원검사 결과가 아닌 OSA 위험평가 설문(STOP-Bang 설문)을 기반으로 정의하였다는 점에서 환자군 분류의 정확도가 떨어질 수 있다. 그러나 STOP-Bang 설문은 높은 진단의 정확도와 사용의 용이성 및 명확한 위험 계층화로 인해 국내외 여러 연구에서 사용되었다[22]. 또한 중등도 이상의 OSA 환자의 선별에서 높은 민감도를 보여[23] 신뢰도가 높은 선별검사로 생각된다. 둘째, 고위험군 OSA 환자의 작은 표본 크기로 통계적 유의성은 확인되었으나 만성 어지럼증에 대한 OSA 고위험군의 95% CI의 폭이 넓었다. 목둘레, 체질량지수 등 STOP-Bang 설문 항목 기준에 의하면 비만도가 상대적으로 높은 서양인과 비교하여 동양인에서 고위험군 OSA로 선별되는 비율은 적을 것이다. 따라서 OSA 저위험군 및 중-고위험군 두 그룹으로 추가 분석을 실시하였으며, 저위험군과 비교하여 중-고위험군에서 만성 어지럼 발생 위험 증가를 입증하였다. 추후 지속적으로 시행되는 국민건강영양조사 원시자료 통합을 통하여 충분한 OSA 고위험군 표본 크기를 확보하여 추가 분석하여 볼 수 있을 것이다. 마지막으로, 본 연구의 단면 조사의 특성으로 인해 OSA와 만성 어지럼의 연관성을 입증할 수는 있었으나 관계를 뒷받침하는 메커니즘을 직접적으로 확인할 수는 없었다.
결론적으로 다수의 OSA 환자에서 어지럼증을 호소할 수 있으므로 다른 주간 및 수면 중 증상 외에도 어지럼증에 대한 임상의의 관심이 필요하다. 또한, 어지럼증을 호소하는 경우에는 전정기능검사, 자율신경계검사, 다른 동반 질환에 대한 평가 등 다각도의 평가를 통해 원인 파악과 증상 개선을 위한 노력이 요구될 것이다.
Acknowledgements
None
Notes
Author Contribution
Conceptualization: Jungmin Ahn. Data curation: Byeong-Cheol Lee. Formal analysis: Byeong-Cheol Lee. Investigation: Brian Kim, Myung-Chul Lee. Project administration: Myung-Chul Lee, Ik Joon Choi. Supervision: Ik Joon Choi, Jungmin Ahn. Writing—original draft: Seong-Eun Hong. Writing—review & editing: Jungmin Ahn.