호산구성 만성 비부비동염 동물모델에서 아바타셉트의 치료효과
Therapeutic Effect of Abatacept (Cytotoxic T Lymphocyte Antigen 4-Fragment Crystallizable) in a Mouse Model of Eosinophilic Chronic Rhinosinusitis
Article information
Trans Abstract
Background and Objectives
Abatacept is a chimeric protein that combines the Fc region of human immunoglobulin G1 with human cytotoxic T-lymphocyte-associated protein-4. Abatacept is increasingly used for inflammatory disease including rheumatoid arthritis. However, the impact of abatacept on chronic rhinosinusitis remains largely unexplored. This study aimed to evaluate the therapeutic potential of abatacept in a mouse model of eosinophilic chronic rhinosinusitis (ECRS).
Materials and Method
The mice were assigned to four different treatment groups: control, ECRS, abatacept-treated (Aba), and dexamethasone-treated (Dexa) groups. To assess the effects of abatacept in the mouse model of ECRS, several techniques were employed, including hematoxylin and eosin staining, Periodic acid-Schiff staining, real-time quantitative polymerase chain reaction, Western blot analysis, and enzyme-linked immunosorbent assay.
Results
Epithelial thickness, the number of goblet cells and eosinophil infiltration in the nasal mucosa, was significantly decreased in the Aba and Dexa groups compared with the ECRS group. The concentrations of interleukin (IL)-10, IL-4, and IL-5 in the nasal lavage fluid were significantly reduced in both the Aba and Dexa groups compared to the ECRS group. Similarly, the expression levels of IL-4, IL-5, IL-10, IL-13, IL-17A, and interferon gamma in the nasal mucosa were markedly lower in the Aba and Dexa groups than in the ECRS group.
Conclusion
Abatacept treatment reduced the number of Th immune response-associated molecules and cytokines, resulting in the suppression of nasal polyp formation and mucosal inflammation in ECRS mice. Based on these results, Abatacept could be considered a potential therapeutic option for patients with ECRS.
서 론
만성 비부비동염(chronic rhinosinusitis, CRS)은 비부비동 점막의 장기간의 염증성 질환으로, 증상이 12주 이상 지속되는 것이 특징이며, 전체 인구의 약 5.5%에 영향을 미치는 흔한 만성 질환이다[1]. 만성 비부비동염은 비용종(nasal polyp, NP)이 있는 CRS (CRS with nasal polyp)와 비용종이 없는 CRS (CRS without nasal polyp)의 두 가지 주요 유형으로 분류되며, 서로 다른 병리생리학적 메커니즘에 따라 두 가지 타입인 제2형 CRS (type 2 CRS)와 아닌 것(non-type 2 CRS)으로 또 분류될 수 있다[2]. 제2형 CRS는 주로 호산구성 CRS (eosinophilic CRS, ECRS)로 특징지어지며, 이는 심각한 점막 염증을 특징으로 하고 빈번한 재발로 인해 치료가 어려운 질환으로 알려져 있다[2]. 제2형 CRS 환자들을 치료하고 관리하기 위해 수술적인 치료와 함께 반복적인 전신 스테로이드 치료가 사용되지만, 치료가 끝나면 증상이 자주 재발하는 특징을 갖는다[3]. 따라서, 이러한 환자들의 치료 결과를 향상시키기 위해서는 임상 효능이 높고 부작용이 적은 새로운 표적 치료법을 개발하거나 생물학적 제제를 재사용하는 것이 필수적이다.
ECRS는 제2형 염증을 유발하는 데 Th2 CD4+ 세포가 중요한 역할을 한다는 것은 널리 알려져 있다. 많은 연구자들은 Th2 CD4+ 세포의 수와 interleukin (IL)-4, IL-5, IL-9, IL-13을 포함한 Th2 사이토카인이 증가하여 염증 반응에 기여함으로써 ECRS의 병인에 중요한 역할을 한다고 지적했다[4,5]. 이러한 발견은 T 세포 활성화와 분화를 관리하는 것이 ECRS와 관련된 면역 반응을 효과적으로 줄일 수 있음을 시사한다.
완전한 T 세포 활성화에는 항원 제시 세포(antigen presenting cells, APC)로부터 두 가지 신호가 필요하다. 첫 번째는 특정 항원을 T 세포 수용체가 인식하는 것이며, 두 번째는 보조 자극 신호이다. 두 번째 신호는 APC 표면에 있는 CD80 (B7-1) 및/또는 CD86 (B7-2)과 T 세포의 CD28 수용체 간의 상호작용을 필요로 한다[6,7]. 활성화되면서 T 세포는 표면에 내인성 세포독성 T 림프구 항원 4 (cytotoxic T-lymphocyte-associated protein-4, CTLA-4)를 발현한다. 세포 독성 T 림프구 항원 4-면역글로불린(CTLA4-immunoglobulin [Ig]; 아바타셉트)은 CTLA-4의 세포 외 도메인과 인간 IgG1의 Fc 영역을 결합한 융합 단백질이다[8]. CTLA4-Ig는 항원 제시 세포의 B7 분자에 CD28보다 높은 친화력으로 결합하여 CD28 매개 T 세포 활성화를 억제하는 역할을 한다[9-11].
많은 임상 연구에서 류마티스 관절염, 전신 홍반성 루푸스, 제1형 당뇨병, 알레르기 비염 등 T 세포 유도 염증과 관련된 질병을 조절하는 데 아바타셉트가 효과가 있음이 입증되었다[12-15]. 하지만 ECRS에서 아바타셉트의 치료 효과에 대한 연구는 없는 상태이며, 본 연구에서는 ECRS 마우스 모델을 이용하여 점막염증반응에 대한 아바타셉트 치료효과를 평가하여 아바타셉트가 ECRS 치료에 잠재적인 치료 효과를 가질 수 있음을 알리고자 한다.
재료 및 방법
동물 모델
18-22 g 사이의 4주령의 암컷 BALB/c 마우스를 OrientBio Laboratory (Sungnam, Republic of Korea)에서 공급 받았으며, 특정 병원체가 없는 환경(specific-pathogen-free)에서 사육하였다. 동물 실험은 충남대학교 동물실험윤리위원회(Institutional Animal Care and Use Committee)에서 승인 받았다(승인 번호: CNUH-020-A0018).
CRS 마우스 실험 프로토콜
마우스 40마리를 네 개의 그룹(Fig. 1): 음성 대조군(CON; n=10), ECRS 양성 대조군(ECRS; n=10), CRS 마우스에서 아바타셉트 치료군(Aba; n=10), CRS 마우스에서 덱사메타손 치료군(Dexa; n=10)으로 나눈 뒤, 이전 연구에서 설명된 방법에 따라 CRS 마우스 모델을 만들었다[16,17]. 마우스는 1일과 5일에 25 μg의 난백알부민(ovalbumin, OVA)과 2 mg의 수산화알루미늄을 복강에 주사하여 감작시켰다. 21일부터 26일까지는 3% 난백알부민 용액 10 μL을 비강 내로 주입하여 주 5회, 4주차부터 12주차까지는 주 3회 반복 노출하였다. 이후 8주차부터 12주차까지 주 3회, 포도상구균 장독소 B (staphylococcus enterotoxin B [SEB]; List Biological Laboratories Inc., Campbell, CA, USA) 10 ng을 비강 내로 주입하였다. 음성 대조군은 인산완충식염수(phosphate-buffered saline, PBS)를 복강 내와 비강 내로 투여하였다(Fig. 1). 비강 내 SEB 투여 1시간 후, Aba 그룹과 Dexa 그룹은 각각 CTLA-4 Fc 조각(Abatacept [Orencia]; Bristol-Myers Squibb, New York, NY, USA) 10 mg/kg 또는 덱사메타손(Dexa, Yuhan Pharma, Seoul, Korea) 1 mg/kg을 8주차부터 12주차까지 주 1회 복강 내로 각각 주사하였다.
조직검체의 준비
OVA를 최종 비강 주입 후 24시간이 지난 다음 모든 마우스를 안락사하였다. 각 그룹의 마우스의 머리는 일괄적으로 제거되었고, 조직학적 분석, 단백질 및 RNA 추출을 위한 샘플을 수집하였다. 비강 세척액(nasal lavage fluid, NALF)을 수집하기 위해 깊은 마취 상태에서 마우스의 기관을 노출시키고 부분적으로 절개한 뒤, 24G IV 카테터(Becton-Dickinson, Sandy, UT, USA)를 기관 절개 부위를 통해 후비공에 삽입하였다. 비강 내를 차가운 PBS 350 μL로 두 번 세척한 후, 콧구멍에서 수집된 액체를 원심 분리하여 상층액은 후속 분석을 위해 -80°C에서 보관하였다. 현미경 하에서 작은 큐렛과 미세 겸자를 사용하여 각 그룹의 마우스 5마리로부터 비강 점막을 수집하여 단백질 및 RNA 추출에 사용하였다. 각 그룹의 나머지 마우스의 머리는 그룹당 5마리씩 4% paraformaldehyde에 2일 동안 고정 후, 표본을 흐르는 수돗물에 세척하여 상온에서 2주 동안 1-methylenediaminetetraacetic acid (pH 8.0)에서 탈회하였다. 표본은 파라핀에 매몰 후, 미세절단기(Leica, Wetzlar, Germany)를 사용하여 비강 전정에서 약 5 mm 떨어진 지점에서 4 μm 두께로 관상 절편을 제작하였다.
조직학적 검사
파라핀에 매몰된 마우스 머리 절편은 제조사의 지침에 따라 hematoxylin and eosin (ab245880; Abcam, Cambridge, UK), Congo Red (아밀로이드 검출용, ab150663; Abcam), Periodic acid-Schiff (ab150680; Abcam)으로 염색하였다. 염색된 슬라이드는 Pannoramic MIDI 디지털 슬라이드 스캐너(Pannoramic software 2.0; 3DHISTECH Ltd., Budapest, Hungary)로 스캔하였고, 평가를 위해 부비동과 가깝게 정렬된 5개의 관상 절편을 선택하여 점막 병변을 확인하였다. 상악동 또는 비강 측벽의 비강 점막 절편에서 무작위로 선택한 10개 부위를 고배율 시야(×400)에서 동물의 그룹 할당을 모르는 두 명의 블라인드 검사자가 관찰하였다. 폴립은 인접한 염증 세포 침윤과 미세 공동이 있는 독립적인 점막 돌출부로 정의하였다. 점막 두께는 상피 세포의 꼭대기부터 상피하선 영역의 상단 경계까지 측정하였다. 점막 두께를 평가하기 위해 각 고배율 시야에서 무작위로 최소 3회 측정을 수행하고, 네 개의 다른 시야에서 얻은 평균 값이 비교에 사용되었다. 두께 측정은 CaseViewer 프로그램(v: 1.15.3; 3DHISTECH Ltd.)을 사용하였다.
비강 조직 내 사이토카인에 대한 reverse transcriptase-polymerase chain reaction 분석
비강 점막에서 총 RNA는 제조사의 프로토콜에 따라 TRIzol™ 시약(Invitrogen, Carlsbad, CA, USA)을 사용하여 추출하였다. cDNA 합성을 위해, 총 RNA 2 μg을 SuperScript First-Strand Synthesis System을 사용하여 제조사의 지침에 따라 역전사하였다. mRNA 발현 수준은 CFX Connect™ 실시간 polymerase chain reaction (PCR) 검출 시스템(Bio-Rad Laboratories, Hercules, CA, USA)과 Power SYBRⓇ Green PCR Master Mix (Life Technologies Ltd., Warrington, UK)이 사용되었다. 프라이머 서열은 GenoTech (Daejeon, Korea)에서 얻었으며, Table 1에 상세 정보를 명시하였다.
모든 PCR 분석은 3회 반복하였고 각 샘플에 대해 표적 유전자와 참조 유전자인 글리세르알데히드 3-인산 탈수소효소(glyceraldehyde-3-phosphate dehydrogenase) 간의 임계 주기 차이(ΔCt 표적 유전자 및 ΔCt 참조 유전자)를 계산하였다. 보정된 델타 Ct 값(ΔΔCt)은 ΔCt 표적 유전자에서 ΔCt 참조 유전자를 뺀 값으로 하였고, 상대 정량화 값은 다음 방정식을 사용하여 계산하였다: 상대 정량화 = 2^-ΔΔCt.
사이토카인 생성 측정
NALF는 원심분리하여 상층액을 수집하였고 NALF 내 IL-4 (M4000B; R&D Systems, Minneapolis, MN, USA), IL-5 (M5000; R&D Systems), IL-10 (M1000B; R&D Systems) 및 IL-13 (DY413; R&D Systems) 농도는 제조사의 지침에 따라 효소결합면역흡착검사(enzyme-linked immunosorbent assay, ELISA)를 사용하여 측정하였다. 450 nm에서의 광학 흡광도 값은 마이크로플레이트 리더를 사용하여 측정하였다.
통계학적 분석
모든 데이터의 분석에는 GraphPad Prism 소프트웨어(v5.0; La Jolla, CA, USA)가 사용되었다. 데이터에는 평균±표준 오차를 표시하였다. 그룹 간의 차이는 일원분산분석(analysis of variance)과 Tukey의 검정을 사용하여 확인하였으며 통계적 유의성은 p<0.05로 정의했다.
결 과
CTLA-4-Fc는 ECRS 마우스 모델에서 점막 염증과 용종의 발생을 감소시킴
용종 점수는 ECRS 그룹에 비해 대조군(p<0.001), Aba 그룹(p<0.05), Dexa 그룹(p<0.01)에서 유의미하게 낮았다(Fig. 2A). 비중격 점막의 상피 두께 또한 ECRS 그룹에 비해 대조군, Aba 그룹, Dexa 그룹에서 모두 유의미하게 낮았고(p<0.0001) (Fig. 2B), Dexa 그룹보다 Aba 그룹에서 유의미하게 낮았다(p<0.01). 배상세포의 수는 대조군(p<0.01), Aba (p<0.05), Dexa (p<0.05) 그룹에서 ECRS 그룹보다 유의미하게 낮았다(Fig. 2C). 비점막의 호산구 수는 대조군(p<0.0001), Aba (p<0.01), Dexa (p<0.0001) 그룹에서 ECRS 그룹보다 유의미하게 감소되었다(Fig. 2D). 이 결과들은 아바타셉트가 ECRS 마우스에서 비강 내 폴립의 발생과 점막 염증을 개선했음을 시사한다. 그 효과는 덱사메타손의 효과와 견줄 수 있는 수준으로 나타났다.
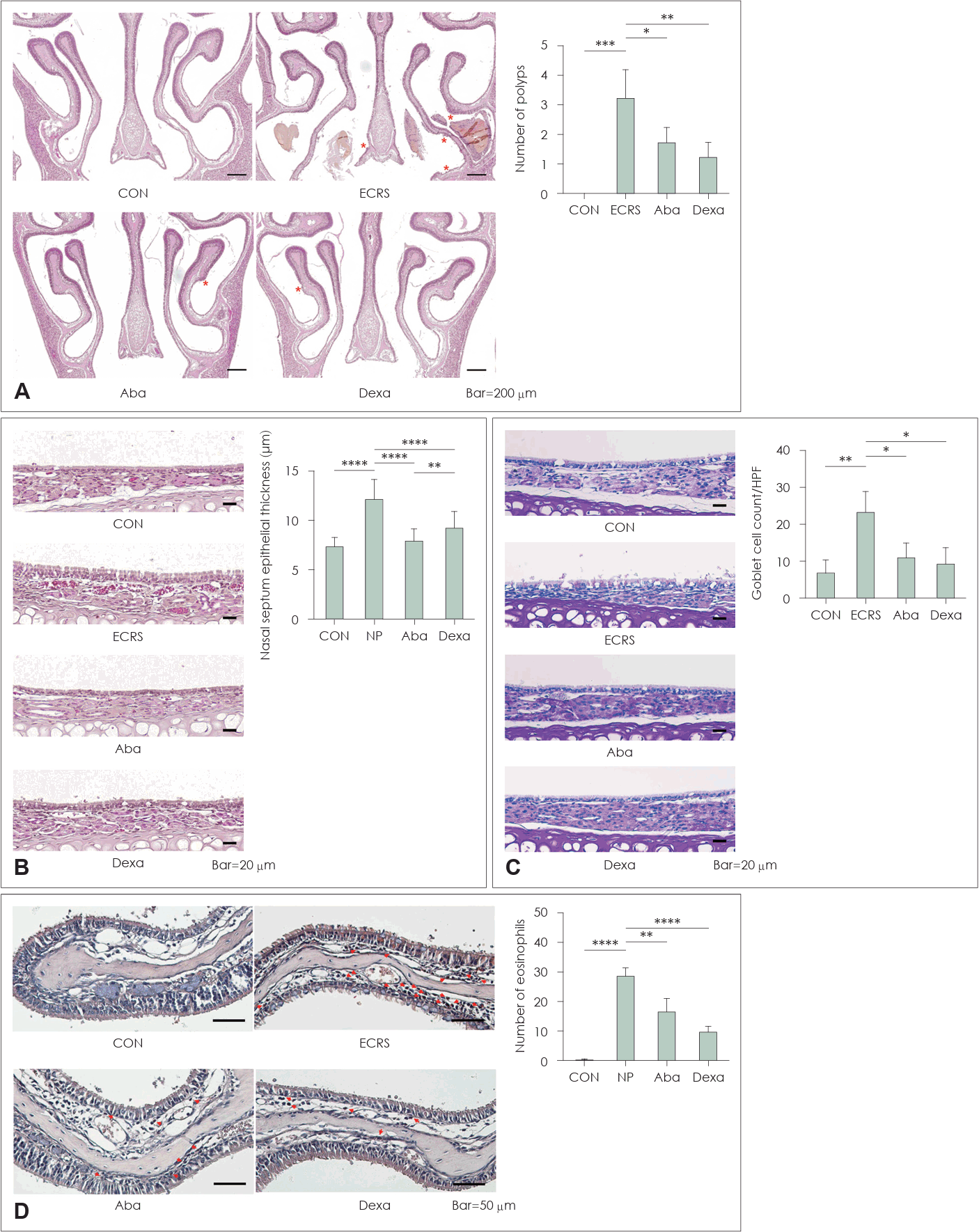
CTLA-4-Fc reduced mucosal inflammation and polyp formation in the ECRS mice. A: A specimen embedded in paraffin and stained with hematoxylin and eosin (H&E) and a following graph showing decreased number of polyps (asterisk) in the Aba and Dexa group. B: H&E stained specimen and a following graph showing the epithelial thickness of each group’s specimen. C: Periodic acid Schiff stained specimen and a following graph showing goblet cell count in each group’s specimen. D: Congo red stained specimen and a following graph showing number of eosinophils in each group’s specimen. *p<0.05; **p<0.01; ***p<0.001; ****p<0.0001. CON, a negative control group; ECRS, positive control group; Aba, abatacept-treated group; Dexa, dexamethasone-treated group.
CTLA-4-Fc는 ECRS 마우스 모델의 NALF에서 Th 사이토카인 생성을 감소시킴
NALF의 제한된 양으로 인해, 4가지 사이토카인(IL-4, IL-5, IL-10, IL-13)만 ELISA로 측정되었다. NALF의 IL-4 농도는 ECRS 그룹에 비해 대조군(p<0.0001), Aba (p<0.0001), Dexa (p<0.01) 그룹에서 유의미하게 낮았다(Fig. 3A). IL-5 농도 역시 ECRS 그룹에 비해 대조군(p<0.05), Aba (p<0.0001), Dexa (p<0.05) 그룹에서 유의미하게 감소하였다(Fig. 3B). IL-10 단백질 수준은 ECRS 그룹에 비해 대조군(p<0.001), Aba (p<0.001), Dexa (p<0.05) 그룹에서 유의미하게 낮았다(Fig. 3C). IL-13 수준은 대조군(p<0.01), Aba (p<0.05), Dexa (p<0.05) 그룹에서 ECRS 그룹보다 유의미하게 낮았다(Fig. 3D). 이는 아바타셉트로 처리된 ECRS 마우스 그룹에서 비강 내에서 분비된 사이토카인이 감소했음을 보여준다.
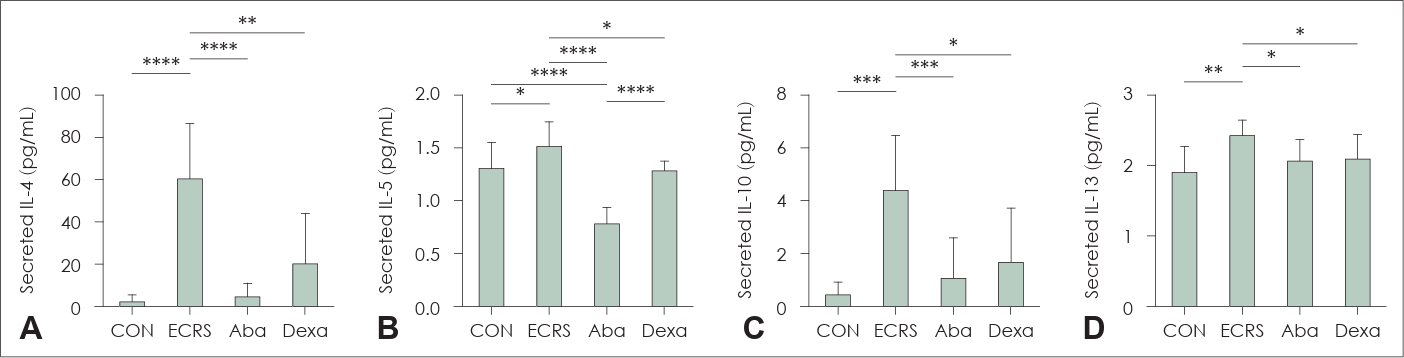
ELISA of the NALF of mice from each group. NALF concentrations of IL-4 (A), IL-5 (B), IL-10 (C), and IL-13 (D) were collected. *p<0.05; **p<0.01; ***p<0.001; ****p<0.0001. ELISA, enzyme-linked immunosorbent assay; NALF, nasal lavage fluid; IL, interleukin; CON, a negative control group; ECRS, positive control group; Aba, abatacept-treated group; Dexa, dexamethasone-treated group.
CTLA-4-Fc는 ECRS 마우스의 비점막에서 Th 사이토카인과 케모카인 발현을 억제함
Th 사이토카인(IFN-γ, IL-4, IL-5, IL-10, IL-13, IL-17A)의 mRNA 발현 수준은 대조군에 비해 ECRS 그룹에서 유의미하게 높았다(p<0.0001, IFN-γ, IL-4, IL-13; p<0.01, IL-5, IL-17A; p<0.05, IL-10) (Fig. 4A-F). 이러한 사이토카인의 억제 효과는 Aba 그룹 (p<0.0001, IFN-γ, IL-4, IL-13; p<0.001, IL-17A; p<0.01, IL-10; p<0.05, IL-5) (Fig. 4A-F) 및 Dexa 그룹(p<0.0001, IFN-γ, IL-4, IL-10, IL-13; p<0.001, IL-17A, TGF-β; p<0.05, IL-5) (Fig. 4A-F)에서 유의미하게 나타났다. 반면, IL-10의 mRNA 발현 수준은 Aba 그룹이 ECRS 그룹보다 더 낮았으나, Dexa 그룹에서는 더 높은 발현을 보였다(Fig. 4D).
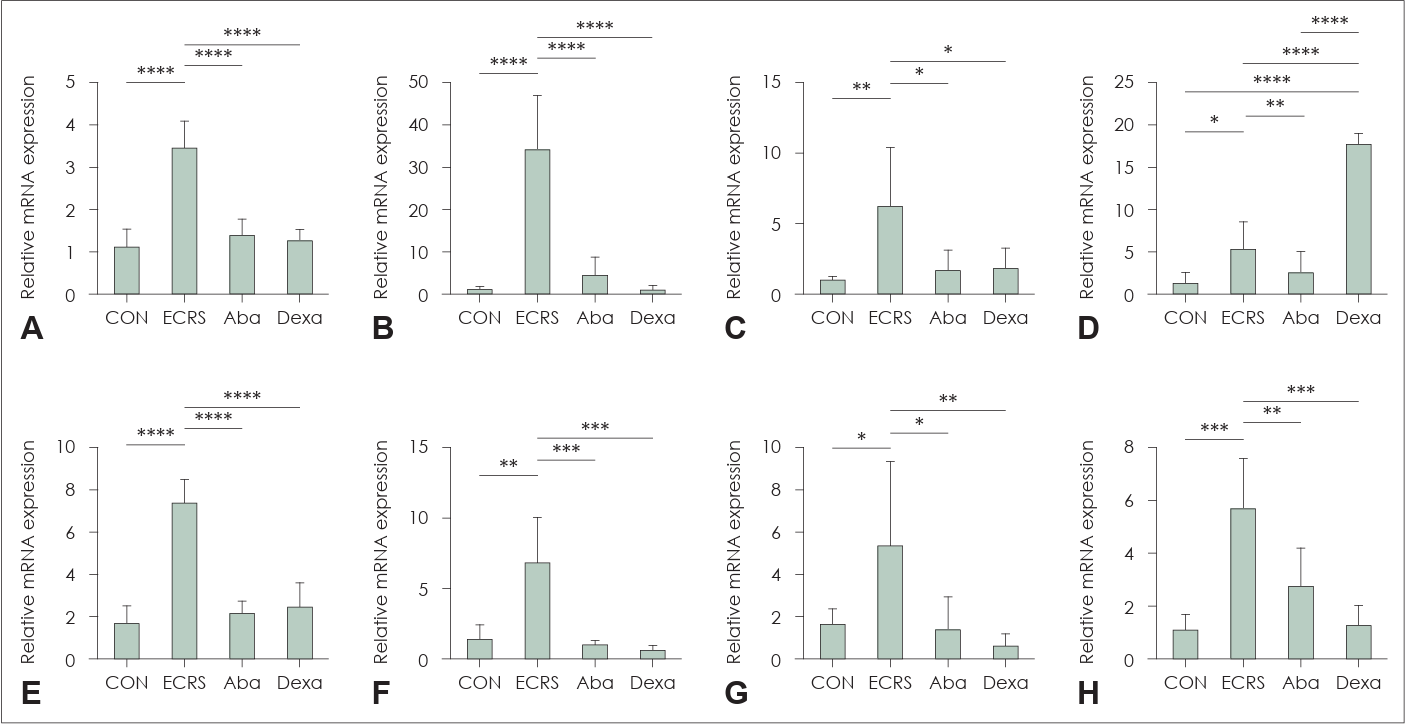
mRNA levels of Th cytokines and chemokines in nasal mucosa revealed by RT-PCR. IFNγ (A), IL-4 (B), IL-5 (C), IL-10 (D), IL-13 (E), IL-17A (F), CCL11 (G), TGF-β (H). *p<0.05; **p<0.01; ***p<0.001; ****p<0.0001. RT-PCR, reverse transcriptase-polymerase chain reaction; IFNγ, interferon gamma; IL, interleukin; CCL, C-C motif chemokine ligand; TGF-β, transforming growth factor-β; CON, a negative control group; ECRS, positive control group; Aba, abatacept-treated group; Dexa, dexamethasone-treated group.
또한 CCL11과 transforming growth factor-β (TGF-β)의 mRNA 발현은 ECRS 그룹에서 대조군보다 유의미하게 높았다(p<0.05, CCL11; p<0.001, TGF-β) (Fig. 4G and H). 이러한 사이토카인의 유도는 Aba 그룹(p<0.05, CCL1; p<0.01, TGF-β) (Fig. 4G and H) 및 Dexa 그룹(p<0.01, CCL1; p<0.001, TGF-β) (Fig. 4G and H)에서 유의미하게 억제되었다.
CTLA-4-Fc는 ECRS 마우스의 비점막에서 Th 전사 인자 발현을 억제하였다
ECRS 마우스의 비점막에서 GATA3, T-bet, Foxp3, RORγt의 mRNA 발현에 대해 확인하였다. GATA3는 대조군, Aba, Dexa 그룹에서 모두 ECRS 그룹보다 낮은 정도로 발현되었다(p<0.0001) (Fig. 5A). 그러나 T-bet의 발현은 ECRS 그룹과 Aba 또는 Dexa 그룹 간에 유의미한 차이를 보이지 않았지만, Aba와 Dexa 그룹이 ECRS 그룹보다 감소하는 경향을 보였다(Fig. 5B). RORγt의 발현은 ECRS (p<0.01) 및 Dexa (p<0.05) 그룹에서 대조군보다 높게 측정되었고(Fig. 5C), ECRS 그룹보다 Aba 그룹에서 증가되었다(p<0.001) (Fig. 5C). Foxp3은 ECRS (p<0.01) 및 Dexa (p<0.01) 그룹에서 대조군보다 유의미하게 증가되어 발현되었다(Fig. 5D).
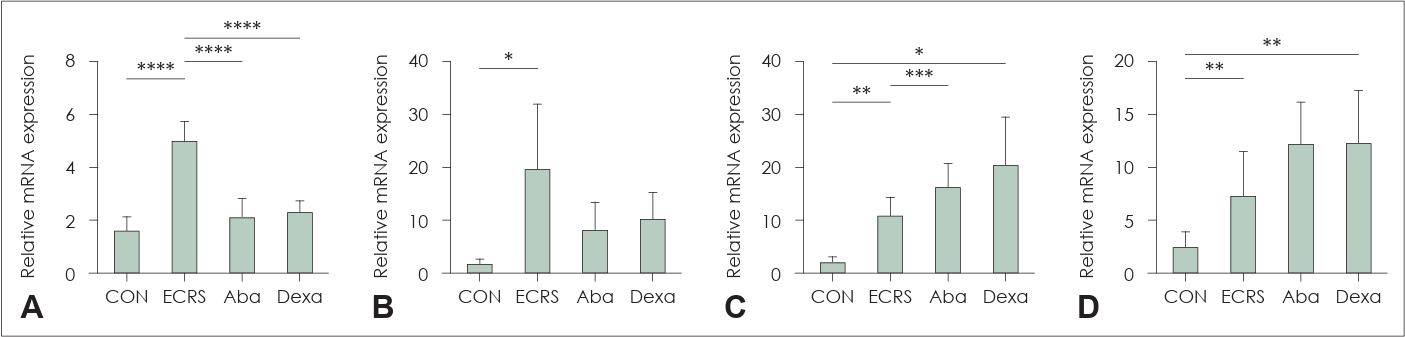
mRNA levels of Th transcription factors in nasal mucosa revealed by RT-PCR. GATA3 (A), T-bet (B), RORγt (C), FOXP3 (D). *p<0.05; **p<0.01; ***p<0.001; ****p<0.0001. RT-PCR, reverse transcriptase-polymerase chain reaction; CON, a negative control group; ECRS, positive control group; Aba, abatacept-treated group; Dexa, dexamethasone-treated group.
고 찰
CRS는 이질적인 염증성 질환이며 두 가지 endotype으로 분류되는데, 두 가지 타입 중 제 2형 CRS는 Th2 CD4+ 세포 활성화와 관련이 있는 것으로 알려져 있다. 이러한 Th2 세포는 특히 ECRS에서 CRScNP의 증상과 조직 손상에 기여하는 것으로 추정되어 CRS 치료에서 중요한 표적 세포로 여겨진다[18]. CTLA-4Ig는 CD80/CD86 수용체와 결합하여 CD28 수용체와의 상호작용을 방지함으로써 T 세포 활성을 억제하는 것으로 잘 알려져 있다[19]. 본 연구에서 사용된 아바타셉트는 CTLA-4Ig의 인간화된 형태(humanized form)로, TNF-α 억제제에 충분히 반응하지 않는 중등도에서 중증의 류마티스 관절염 환자에서 사용하여 그 치료 효과가 입증되었다[20, 21].
이전의 동물모델을 통한 연구에서 아바타셉트가 알레르기성 기도 염증에 효과가 있음을 증명하였는데, 아바타셉트는 기도 호산구증을 감소시키고 기도 염증을 억제하였다[22,23]. 하지만, 동물 모델에서의 긍정적인 결과와 달리 인간을 대상으로 한 연구 결과에서는 눈 여겨볼만한 효과를 확인하지는 못하였다. Parulekar 등[24]의 연구에 따르면 아바타셉트의 투여가 천식 환자에서 염증 반응에 아무런 효과가 없었고, Adelshaeed 등[25]은 아바타셉트가 천식의 증상과 호산구성 염증을 조절하는 데 실패하였다고 보고하기도 하였다. 하지만, OVA로 유도된 천식마우스 모델에서 CTLA-4Ig의 복강 내 투여는 폐의 염증을 감소시켰고, 반대로 CTLA-4Ig를 차단하면 호산구성 폐 침윤과 bronchoalveolar lavage fluid (BALF)내 호산구 수치가 증가하였다[26]. 또한 CTLA-4의 세포질 도메인의 비강 내 투여는 OVA 감작 쥐의 BALF에서 IL-4, IL-5, IL-13을 포함한 Th-2 사이토카인 수치를 감소시켰다[27]. ECRS의 염증에 대한 CTLA-4Ig의 효과에 대해서는 상대적으로 알려진 바가 적다. 따라서, 본 연구에서는 ECRS에서 아바타셉트의 치료 효과를 조사하고자 하였고, ECRS 마우스 모델에서 조직학적 소견, Th 사이토카인, 케모카인 수준 및 비점막 조직 또는 비세척액에서 전사 인자 발현을 분석하였다. 그 결과, 아바타셉트는 ECRS 마우스에서 점막 염증 및 관련 면역 반응을 개선함을 알 수 있었다.
CD28 의존적 T 세포 억제 메커니즘 외에도, 아바타셉트가 조절 T 세포(Tregs)의 증식을 촉진하여 면역 억제 기능이 강화된다는 보고가 있다[28,29]. 하지만, abatacept의 Treg에 대한 영향은 문헌들 사이에서도 정해진 바가 없다. 일반적으로 아바타셉트 치료 후 Treg의 수가 크게 감소하는 것으로 관찰된다고 하나, Bonelli 등 및 Nakachi 등의 연구에서는 그 수가 통계학적으로 유의미하게 증가한 결과를 보였다[8,28,30-32]. 본 연구에서는 Aba 그룹이 ECRS 그룹에 비해 Treg 기능과 관련된 것으로 알려진 IL-10 및 TGF-β의 발현이 낮았고, 조절 T 세포의 전사 인자인 FOXP3의 발현은 ECRS 그룹에 비해 증가했음을 보여주었으나 통계적으로 유의미한 차이는 없었다. 본 연구에서는 점막 점막시료가 충분하지 않아 Tregs의 전사인자에 대한 단백질 수준의 실험 또는 flow cytometry 분석이 이루어지지 않았지만, 아바타셉트치료와 Tregs의 역학관계를 더 정확히 알기위해서는 이러한 실험들이 추후에 추가로 필요할 것으로 생각하였다.
포도상구균 장독소 B (SEB)는 항원 제시 세포/T 세포 연접에서 수용체에 결합하여 T 세포 증식을 증가시키고 생체 내 사이토카인 폭풍 증후군을 유도하는 초항원으로 작용한다고 알려져 있다[33]. 따라서 CTLA-4Ig 합성 단백질에 의한 T 세포 공동 자극 신호 차단은 SEB와 관련된 초항원 반응을 예방할 수 있다. Whitifield 등[34]은 SEB 노출 8시간 후 아바타셉트 단회 투여를 받은 쥐가 아바타셉트를 받지 않은 SEB 노출 대조군 쥐에 비해 병리학적 변화가 감소한 것을 보고한 바 있다. SEB에 노출된 쥐는 4일에서 9일 사이에 상당히 체중이 감소한 반면, 아바타셉트를 투여받은 SEB 노출 쥐는 연구 기간 내내 체중 감소가 없었으며, 이는 아바타셉트가 SEB 유발 이환율을 감소시킬 수 있다는 가능성을 시사한다.
포도상구균 초항원, 특히 SEB가 CRS와 비강 폴립의 유발에 관여한다는 것은 이미 이전 연구들에 언급된 바 있다[35,36]. 이 SEB와 CRSwNP 사이의 관계를 기반으로 본 연구에서 ECRS 쥐 모델을 만들었으며, 이전 연구 방법에 따라 ECRS 마우스 모델 생성 과정에서 SEB를 사용하고, SEB 사용 기간 동안 아바타셉트로 치료하였다[17]. 치료 그룹(Aba)에서 나타난 효과는 아바타셉트의 T 세포 활성화 차단 효과로 인해 SEB의 슈퍼항원 효과가 약화된 결과로 나타났을 가능성이 있다. 따라서 아바타셉트의 효과는 이미 ECRS가 발병한 경우는 미미할 수 있으나, CRS의 급성 악화의 경우 어느 정도 효과적일 수 있을 것으로 사료되나 향후 이에 대한 추가 연구가 필요하다.
본 연구는 CRS 마우스 모델에서 아바타셉트의 효과를 처음으로 보여준 연구로, 아바타셉트가 호산구성 염증을 감소시키고 Th 사이토카인 및 Th1, Th2의 전사 인자를 억제할 수 있다는 것을 보여주었다. 이 연구의 제한점으로는 천식 환자에서 수행된 이전 연구 결과에서와 같이, 동물 연구의 결과가 인간에서 다르게 나올 수 있다는 부분이 있다. 또한, 비강세척액 내에 control 군의 IL-5의 농도(Fig. 3B)가 양성대조군에 비해서는 낮은 농도를 보였지만 치료군(Aba군과 Dexa군)에 비해서는 높게 측정이 되었다. 이러한 결과는 비강세척액내에 IL-5의 농도가 원천적으로 높지 않고 채취되는 비강세척액의 양이 제한되어 IL-5의 정확한 농도의 측정에 어려움이 있었기 때문으로 생각된다. 따라서, 아바타셉트를 CRS의 치료 방법 중 하나로 인정하기 위해서는 인간 대상으로 진행하는 추가 연구가 필수적일 것이다.
결론적으로, 아바타셉트 치료는 Th 면역 반응 관련 분자와 사이토카인을 억제하면서 ECRS 마우스의 비강 내 폴립 형성과 점막 염증을 조절하였다. CRS에 대한 가능한 치료 옵션으로서 아바타셉트의 치료 가능성을 증명하기 위해서는 임상 시험을 포함하여 더 많은 연구가 필요할 것으로 사료된다.
Acknowledgements
This work was supported by Research fund of Chungnam National University.
Abatacept was supplied by Bristol-Myers Squibb.
Notes
Author contributions
Conceptualization: Yong Min Kim, Soo Kyoung Park. Data curation: Jaein Chung, Hyo One Son. Formal analysis: Jaein Chung, Soo Kyoung Park. Funding acquisition: Yong Min Kim. Software: Jaein Chung. Supervision: Yong Min Kim. Validation: Soo Kyoung Park. Writing—original draft: Yong Min Kim. Writing—review & editing: Yong Min Kim, Jaein Chung.


