 |
 |
AbstractBiphenotypic sinonasal sarcoma (BSNS) is a newly recognized, very rare malignant tumor of nose and paranasal sinuses, which usually occurs in women. This tumor contains both neural and muscle tissue in the tumor tissue. It is an invasive disease occuring locally in the nasal cavity. However, if not found early, it can spread along the facial structure, for instance, the orbit, skull base, intracranium, and the oropharynx. This tumor is an uncommon disease that has not been reported in Korea to date. We report a case of a 35-year-old female recently diagnosed with BSNS with a review of the literature.
м„ң лЎмңЎмў…(sarcoma)мқҖ мӨ‘к°„м—ҪмЎ°м§Ғм—җм„ң кё°мӣҗн•ң кІ°н•©мЎ°м§Ғ, лјҲ, к·јмңЎ л“ұмңјлЎңл¶Җн„° кё°мӣҗн•ң м•…м„ұмў…м–‘мқҙлӢӨ. мқҙмӨ‘н‘ңнҳ„нҳ• 비л¶Җ비лҸҷ мңЎмў…(biphenotypic sinonasal sarcoma, BSNS)мқҖ мӢ кІҪмЎ°м§Ғкіј к·јмңЎмЎ°м§Ғмқ„ н•Ёк»ҳ нҸ¬н•Ён•ҳлҠ” л°ңмғқм Ғ нҠ№м§•мқ„ к°Җм§Җл©° 비강 кө¬мЎ°лӮҙм—җм„ң нҳ•м„ұлҗҳлҠ” м•…м„ұ мў…м–‘мңјлЎң, нҳ„мһ¬к№Ңм§Җ көӯлӮҙм—җ ліҙкі лҗң л°”к°Җ м—ҶлӢӨ[1,2]. мқҙлҠ” мЈјлЎң м—¬м„ұм—җм„ң л°ңмғқн•ҳкі л№„к°• л°Ҹ л¶Җ비лҸҷ лӮҙм—җм„ң көӯмҶҢм ҒмңјлЎң л°ңмғқн•ҳлӮҳ мЎ°кё°м—җ л°ңкІ¬лҗҳм§Җ м•Ҡмңјл©ҙ м•Ҳл©ҙмқҳ кө¬мЎ°лҘј л”°лқјм„ң нҚјм§Ҳ мҲҳ мһҲлҠ” м№ЁмҠөм Ғмқё м§ҲнҷҳмқҙлӢӨ[3].
м Җмһҗл“ӨмқҖ 비нҸҗмғүкіј 비м¶ңнҳҲмқ„ мЈјмҶҢлЎң лӮҙмӣҗн•ң 35м„ё м—¬м„ұ нҷҳмһҗм—җм„ң BSNSлҘј 진лӢЁн•ҳкі м№ҳн—ҳн•ҳмҳҖкё°м—җ л¬ён—Ң кі м°°кіј н•Ёк»ҳ ліҙкі н•ҳлҠ” л°”мқҙлӢӨ.
мҰқ лЎҖ35м„ё м—¬м„ұмқҙ 2к°ңмӣ” м •лҸ„мқҳ мўҢмёЎ 비нҸҗмғүмқ„ мЈјмҶҢлЎң мҷёлһҳм—җ лӮҙмӣҗн•ҳмҳҖлӢӨ. нҷҳмһҗлҠ” 비мҰқмғҒ мҷё лӢӨлҘё мҰқмғҒмқҖ м—Ҷм—Ҳмңјл©° к·ё мҷё кіјкұ°л Ҙ, к°ҖмЎұл Ҙ, м§Ғм—…л ҘмғҒ нҠ№мқҙн•ң мӮ¬н•ӯмқҖ м—Ҷм—ҲлӢӨ. лӮҙмӣҗ лӢ№мӢң мӢңн–үн•ң 비강 лӮҙмӢңкІҪ кІҖмӮ¬мғҒ 비мӨ‘кІ© нҺёмң„к°Җ ліҙмқҙкі нҺёмң„лҗң мӨ‘кІ© л’ӨмӘҪм—җ 비мқёл‘җ мў…кҙҙк°Җ нҷ•мқёлҗҳм—ҲлӢӨ(Fig. 1).
л¶Җ비лҸҷ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒ кІ°кіј, мўҢмёЎ 비강м—җ 3 cm нҒ¬кё°мқҳ кІҪкі„к°Җ лӘ…нҷ•н•ң мЎ°мҳҒ мҰқк°•лҗң мў…кҙҙк°Җ кҙҖм°°лҗҳм—ҲлӢӨ(Fig. 2). м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒмғҒ мў…кҙҙлҠ” мўҢмёЎ 비강мқ„ мұ„мҡ°кі л‘җк°ңм Җл¶ҖлӮҳ м•ҲмҷҖ, мғҒм•…лҸҷмқ„ м№ЁлІ”н•ҳм§Җ м•ҠмқҖ м–‘мғҒмқ„ ліҙмҳҖлӢӨ. лҳҗн•ң нҳҲкҙҖмқҙ кіјлӢӨ분нҸ¬лҗң лӘЁмҠөмқ„ лӮҳнғҖлӮҙм–ҙ нҳҲкҙҖ섬мң мў…(angiofibroma) лҳҗлҠ” кі лҰҪм„ұ섬мң мў…(solitary fibrous tumor)мқҙ мқҳмӢ¬лҗҳм–ҙ 비л¶Җ비лҸҷ мһҗкё°кіөлӘ…мҳҒмғҒмқ„ мӢңн–үн•ҳмҳҖлӢӨ. 비л¶Җ비лҸҷ мһҗкё°кіөлӘ…мҳҒмғҒ T2 к°•мЎ°мҳҒмғҒм—җм„ң мў…кҙҙлҠ” м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒм—җм„ң лӮҳнғҖлӮң лІ”мң„ мқҙмғҒмқҳ м№ЁлІ”мқ„ ліҙмқҙм§Җ м•Ҡмңјл©° м Җк°•лҸ„ мӢ нҳёмҷҖ кі к°•лҸ„ мӢ нҳёк°Җ л¶Ҳк·ңм№ҷн•ҳкІҢ л°°м—ҙлҗң мғҒнғңлЎң м „л°ҳм Ғмқё м Җк°•лҸ„ мӢ нҳёлҘј ліҙмҳҖкі (Fig. 3A and B), T1 к°•мЎ°мҳҒмғҒм—җм„ң мЎ°мҳҒмҰқк°• мҶҢкІ¬мқҙ ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ(Fig. 3C and D). мқјл°ҳм ҒмңјлЎң нҳҲкҙҖ섬мң мў…мқҙлӮҳ кі лҰҪм„ұ 섬мң мў…мқҖ T1м—җм„ң лҸҷл“ұ лҳҗлҠ” м Җк°•лҸ„ мӢ нҳёк°•лҸ„лҘј ліҙмқҙкі , T2м—җм„ң м ҖмӢ нҳёк°•лҸ„ л°Ҹ кі мӢ нҳёк°•лҸ„мқҳ л¶Ҳк·ңм№ҷн•ң л°°м—ҙмқҙ лӮҳнғҖлӮҳкІҢ лҗҳкі , ліё мҰқлЎҖ лҳҗн•ң нҳҲкҙҖ 섬мң мў… лҳҗлҠ” кі лҰҪм„ұ 섬мң мў…мңјлЎң мқҳмӢ¬лҗҳм–ҙ нҳҲкҙҖмЎ°мҳҒмҲ мқ„ мӢңн–үн•ҳкё°лЎң н•ҳмҳҖлӢӨ.
мҙ¬мҳҒ мҳҲм •мқј м „, нҷҳмһҗлҠ” мҲҳ мӢңк°„ м§ҖмҶҚлҗң 비м¶ңнҳҲмқ„ мЈјмҶҢлЎң мқ‘кёүмӢӨмқ„ нҶөн•ҙ лӮҙмӣҗн•ҳм—¬ мқ‘кёү нҳҲкҙҖмЎ°мҳҒмҲ мқ„ мӢңн–үн•ҳмҳҖмңјл©°, л°”к№ҘлӘ©лҸҷл§Ҙ(external carotid artery)м—җм„ң кё°мӣҗн•ҳлҠ” мҳҒм–‘лҸҷл§Ҙмқё мўҢмёЎ лӮҙмёЎ мғҒм•…лҸҷл§Ҙ(left internal maxillary artery)мқ„ polyvinyl alcoholмқ„ мқҙмҡ©н•ҳм—¬ мғүм „мҲ мқ„ мӢңн–үн•ҳмҳҖлӢӨ(Fig. 4). мғүм „мҲ мқ„ нҶөн•ҙ м¶ңнҳҲмқҙ мЎ°м Ҳлҗң н•ҳлЈЁ л’Ө, м „мӢ л§Ҳм·Ён•ҳ мҲҳмҲ мқ„ мӢңн–үн•ҳмҳҖлӢӨ. лЁјм Җ 비мӨ‘кІ© көҗм •мҲ мқ„ н•ҳм—¬ мҷјмӘҪмқҳ 비강 лӮҙ мў…м–‘мқ„ нҷ•мқё нӣ„, мӨ‘비갑к°ңлҘј мқјл¶Җ м ңкұ°н•ң нӣ„ мў…м–‘мқҳ кІҪкі„лҘј нҷ•мқён•ҳмҳҖкі , нӣ„비강мқҳ лӮҳ비мһ…мІңмһҘ мҳӨлӘ©(sphenopalatine fossa)м—җ мў…м–‘мқҳ лҝҢлҰ¬(stalk)лҘј нҷ•мқён•ҳмҳҖлӢӨ. мў…м–‘мқҖ мЈјліҖ мЎ°м§Ғкіјмқҳ мң м°©мқҖ м—Ҷм—Ҳмңјл©°, мқҙлҘј мҷ„м „ м ңкұ° нӣ„ м–‘к·№м„ұ мҶҢмһ‘кё°(bipolar electrocauterizer)лЎң м¶ңнҳҲмқ„ мЎ°м Ҳн•ҳкі мў…м–‘мқ„ м ңкұ°н•ң кІҪкі„л¶Җ분мқ„ мҶҢмһ‘н•ҳмҳҖлӢӨ. мҲ м „ мғүм „мҲ мқ„ мӢңн–үн•ҳмҳҖкё°м—җ м¶ңнҳҲмқҳ м–‘мқҖ л§Һм§Җ м•Ҡм•ҳлӢӨ. м Ғм¶ңлҗң мў…м–‘мқҖ мңЎм•Ҳм ҒмңјлЎң н•‘нҒ¬мғүмқҳ мў…кҙҙмҳҖкі нҒ¬кё°лҠ” 31Г—15Г—24 mmмҳҖлӢӨ. лі‘лҰ¬мЎ°м§Ғн•ҷм Ғ мҶҢкІ¬мғҒ 비강 м җл§үмқҳ к°„м§Ҳ лӮҙлЎң 방추нҳ•м„ёнҸ¬(spindle cell)к°Җ лҶ’мқҖ м„ёнҸ¬ л°ҖлҸ„лЎң мҰқмӢқн•ҳл©ҙм„ң м№ЁмңӨн•ҳлҠ” лӘЁмҠөмқҙ кҙҖм°°лҗҳм—ҲлӢӨ. 방추нҳ•м„ёнҸ¬мқҳ н•өм—јмғүм§ҲмқҖ к· м§Ҳн•ҳл©° н•өмҶҢмІҙлҸ„ кҙҖм°°лҗҳм§Җ м•Ҡкі л©ҙм—ӯмЎ°м§Ғнҷ”н•ҷм—јмғүмқ„ нҶөн•ҙм„ң 방추нҳ• м„ёнҸ¬к°Җ neural markerмқё S-100 proteinкіј myogenic markerмқё smooth muscle actin (SMA)мқ„ лҸҷмӢңм—җ ліҙмқёлӢӨлҠ” кІғмқ„ нҷ•мқён• мҲҳк°Җ мһҲм—ҲлӢӨ(Fig. 5). нҷҳмһҗлҠ” нҳ„лҜёкІҪн•ҷм Ғ мҶҢкІ¬кіј л©ҙм—ӯмЎ°м§Ғнҷ”н•ҷм—јмғү мҶҢкІ¬мңјлЎң BSNSлЎң мөңмў… 진лӢЁлҗҳм—ҲлӢӨ.
нҷҳмһҗмқҳ мҲҳмҲ нӣ„ мһ…мӣҗкё°к°„ лҸҷм•Ҳ 비м¶ңнҳҲ л°Ҹ м•Ҳкө¬мҰқмғҒмқҙлӮҳ лӢӨлҘё н•©лі‘мҰқмқҖ м—Ҷм—Ҳмңјл©°, нҮҙмӣҗ нӣ„ м „мқҙ м—¬л¶ҖлҘј нҸүк°Җн•ҳкё° мң„н•ҙ мӢңн–үн•ң м „мӢ лјҲ мҠӨмә”(whole body bone scan), м–‘м „мһҗл°©м¶ңлӢЁмёөмҙ¬мҳҒ(18F-fluorodeoxyglucose PET CT)м—җм„ң м „мқҙлҠ” кҙҖм°°лҗҳм§Җ м•Ҡм•ҳлӢӨ. нҷҳмһҗлҠ” мҲҳмҲ нӣ„ 4к°ңмӣ” лҸҷм•Ҳ мҙқ 30нҡҢм—җ кұёміҗ 5920 cGY л°©мӮ¬м„ м№ҳлЈҢлҘј мӢңн–үн•ҳкі мў…лЈҢн•ҳмҳҖлӢӨ. мҲҳмҲ нӣ„ 8к°ңмӣ”м§ё мҷёлһҳ 추м Ғ кҙҖм°° мӨ‘мқҙл©°, лӮҙмӢңкІҪ мҶҢкІ¬кіј м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒмғҒ мһ¬л°ңмҶҢкІ¬мқҖ ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ(Fig. 6).
кі м°°BSNSлҠ” нҠ№м§•м Ғмқё лі‘лҰ¬, л©ҙм—ӯмЎ°м§Ғнҷ”н•ҷм—јмғү л°Ҹ paired box 3 gene (PAX3)кіј mastermind like protein 3 gene (MAML3) мңөн•©мқҳ л°ңкІ¬(PAX3-MAML3 fusion)мңјлЎң мғҲлЎң 분лҘҳлҗҳкё° мқҙм „к№Ңм§Җ мЎ°м§Ғн•ҷм ҒмңјлЎң мң мӮ¬н•ң 섬мң мңЎмў…(fibrosarcoma), нҸүнҷңк·јмңЎмў…(leiomyosarcoma), м•…м„ұл§җмҙҲмӢ кІҪмҙҲмў…м–‘(malignant peripheral nerve sheath tumor), м„ёнҸ¬ мӢ кІҪмҙҲмў…(cellular schwannoma), нҷңл§үмңЎмў…(synovial sarcoma)м—җ нҸ¬н•Ёлҗҳм–ҙ 진лӢЁлҗҳм–ҙ мҷ”лӢӨ. мқҙлҠ” 비л¶Җ비лҸҷ лӮҙм—җм„ң нҠ№м§•м ҒмңјлЎң л°ңкІ¬лҗҳл©°[1] мЈјлЎң м—¬м„ұм—җкІҢм„ң лӮҳнғҖлӮңлӢӨ. Chitguppi л“ұ[4]мқҳ м—°кө¬м—җ мқҳн•ҳл©ҙ 95лӘ…мқҳ нҷҳмһҗ мӨ‘ лӮЁм—¬мқҳ 비мңЁмқҖ 1:2.27лЎң м—¬м„ұм—җм„ң нҳёл°ңн•ҳмҳҖкі , 진лӢЁ лӢ№мӢң лӮҳмқҙлҠ” нҸүк· 52.36м„ё(range: 24-87)мҳҖмңјл©°, ліё мҰқлЎҖмқҳ кІҪмҡ° 35м„ё м—¬м„ұмңјлЎң нҸүк· м—җ 비н•ҙ 비көҗм Ғ м ҠмқҖ лӮҳмқҙм—җ л°ңмғқн•ҳмҳҖлӢӨ. мЈјлЎң л°ңмғқн•ҳлҠ” л¶Җмң„лҠ” 비강м—җм„ң 18кұҙ(18.94%), л¶Җ비лҸҷм—җм„ң 29кұҙ(30.52%), 비강과 л¶Җ비лҸҷ лҸҷмӢңм—җм„ң 29кұҙ(13.68%) кё°мӣҗн•ҳмҳҖмңјл©°, 35кұҙ(36.84%)мқҖ кё°мӣҗ лҜёмғҒмқҙм—ҲлӢӨ. мқҙ мў…м–‘мқҖ мқјл°ҳм ҒмңјлЎң көӯмҶҢм ҒмңјлЎң л°ңмғқн•ҳлӮҳ мЎ°кё°м—җ л°ңкІ¬лҗҳм§Җ м•Ҡмңјл©ҙ м•Ҳл©ҙмқҳ кө¬мЎ°лҘј л”°лқјм„ң нҚјм§Ҳ мҲҳ мһҲлҠ” м№ЁмҠөм Ғмқё м§ҲнҷҳмңјлЎң, 95кұҙ мӨ‘ 비л¶Җ비лҸҷмқ„ л„ҳм–ҙ м№ЁлІ”н•ң кІҪмҡ°лҠ” 27кұҙ(28%)мңјлЎң к·ё мӨ‘ л‘җк°ңм ҖлҘј м№ЁлІ”н•ң кІғмқҖ 10кұҙ(37.03%), м•ҲмҷҖлҘј м№ЁлІ”н•ң кІғмқҖ 12кұҙ(44.44%), л‘җк°ң лӮҙлЎң м№ЁлІ”н•ң кІғмқҖ 4кұҙ(14.81%), кө¬мқёл‘җлЎң м№ЁлІ”н•ң кІғмқҖ 1кұҙ(3.7%)мңјлЎң лӮҳнғҖлӮ¬лӢӨ. BSNSмқҳ мһ„мғҒмҰқмғҒмқҖ м№ЁлІ” лІ”мң„м—җ л”°лқј 비нҸҗмғү, 비분비물, 비м¶ңнҳҲ, нӣ„к°Ғм Җн•ҳмҷҖ к°ҷмқҖ 비мҰқмғҒм—җм„ңл¶Җн„° м•Ҳл©ҙнҶөмҰқ, м•Ҳл©ҙ л¶Җмў…кіј к°ҷмқҖ л¶Җ비лҸҷ м№ЁлІ” мҰқмғҒ, ліөмӢң, мӢңм•јмһҘм• мҷҖ к°ҷмқҖ м•Ҳкө¬ м№ЁлІ”мқҳ мҰқмғҒк№Ңм§Җ лӢӨм–‘н•ҳкІҢ лӮҳнғҖлӮҳкІҢ лҗңлӢӨ[1,4].
BSNSмқҳ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒмқҳ нҠ№м§•м Ғмқё мҶҢкІ¬ мӨ‘ н•ҳлӮҳлҠ” мЈјліҖ лјҲлҘј м№ЁмӢқн•ҳлҠ” кІғмңјлЎң мЈјлЎң м§ҖнҢҗ(lamina papyracea), 비мӨ‘кІ©, м•ҲмҷҖ, л‘җк°ңм Җл¶Җ л“ұмқҳ м№ЁлІ”мқ„ ліј мҲҳ мһҲлӢӨ[4,5]. лҳҗн•ң кіЁкіјлӢӨмҰқ(hyperostosis)мқҙ л‘җл“ңлҹ¬м§ҖкІҢ лӮҳнғҖлӮ мҲҳ мһҲмңјлӮҳ, мқҙлҠ” мҲҳл§үмў…(meningioma), м–‘м„ұ 비종양, лӢӨлҘё л¶Җ비лҸҷ м•…м„ұмў…м–‘, м—јмҰқм„ұ м§Ҳнҷҳ л“ұм—җлҸ„ лӮҳнғҖлӮ мҲҳ мһҲлӢӨ[6-8]. ліё мҰқлЎҖмқҳ кІҪмҡ° м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒмғҒ 비강 мЈјліҖмқҳ лӢӨлҘё кө¬мЎ°л¬јмқҳ м№ЁмӢқмҶҢкІ¬мқҖ ліҙмқҙм§Җ м•Ҡм•ҳмңјл©° кіЁкіјлӢӨмҰқлҸ„ ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ.
мһҗкё°кіөлӘ…мҳҒмғҒмқҖ мў…м–‘мқҳ м•Ҳкө¬лӮҳ л‘җк°ң лӮҙ м№ЁлІ” лІ”мң„лҘј лӘ…нҷ•нһҲ м•Ң мҲҳ мһҲлӢӨ. к·ёлҹ¬лӮҳ мһҗкё°кіөлӘ…мҳҒмғҒ мӨ‘ T1 к°•мЎ°мҳҒмғҒм—җм„ң BSNSмқҳ мЎ°мҳҒмҰқк°• нҢЁн„ҙмқҖ нҠ№м§•м Ғмқҙм§Җ м•ҠлӢӨ. к·ёлҹ¬лӮҳ T2 к°•мЎ°мҳҒмғҒм—җм„ң лҢҖлҮҢ нҡҢл°ұм§Ҳкіј мң мӮ¬н•ң мӢ нҳёлҘј ліҙм—¬мЈјлҠ” кІҪмҡ°к°Җ л§Һмңјл©°, лӢӨлҘё л§ҺмқҖ 비л¶Җ비лҸҷ мў…м–‘ліҙлӢӨ лӮ®мқҖ мӢ нҳёлҘј лӮҳнғҖлӮҙкІҢ лҗңлӢӨ. мқҙлҠ” 섬мң нҷ”лҗң мў…м–‘ лҳҗлҠ” кі лҸ„мқҳ м„ёнҸ¬нҷ”лҗң мў…м–‘(highly cellular tumor)м—җм„ң нқ”н•ҳл©°, BSNSлҠ” кі лҸ„мқҳ м„ёнҸ¬м„ұмқ„ нҠ№м§•мңјлЎң н•ҳлҠ” 방추 м„ёнҸ¬ мў…м–‘(spindle cell neoplasm)мңјлЎң мқҙмҷҖ к°ҷмқҖ нҠ№м§•мқ„ ліҙмқҙкІҢ лҗңлӢӨ. лҳҗн•ң BSNSлҠ” T2 к°•мЎ°мҳҒмғҒм—җм„ң м Җк°•лҸ„мӢ нҳё л°Ҹ кі к°•лҸ„мӢ нҳёмқҳ л¶Ҳк·ңм№ҷн•ң л°°м—ҙмқ„ ліҙмқҙлҠ” кІҪмҡ°к°Җ л§ҺлӢӨ[5]. ліё мҰқлЎҖмқҳ кІҪмҡ°лҸ„ л§Ҳм°¬к°Җм§ҖлЎң T2 к°•мЎ°мҳҒмғҒм—җм„ң мқҙм§Ҳм Ғмқё мЎ°мҳҒмҰқк°•(heterogenous enhancement)мқ„ ліҙмҳҖлӢӨ. к·ёлҹ¬лӮҳ BSNSлҠ” T2 к°•мЎ°мҳҒмғҒм—җм„ң к· мқјн•ҳкІҢ мЎ°мҳҒмҰқк°•(homogenous enhancement)мқҙ лҗҳлҠ” кІҪмҡ°лҸ„ л°ңкІ¬лҗҳкё°лҸ„ н•ңлӢӨ[5].
BSNSмқҳ 진лӢЁмқҖ мЎ°м§Ғн•ҷм Ғ мҶҢкІ¬мңјлЎң мқҙлЈЁм–ҙм§Җл©°, нҠ№нһҲ neural markerмқё S-100 proteinкіј myogenic markerмқё SMAм—җ лҢҖн•ң л©ҙм—ӯн•ҷм Ғ нҷңм„ұлҸ„лҘј ліҙмқҙкі neural crest differentiation markerмқё SRY-related HMG-box 10м—җ лҢҖн•ң мқҢм„ұмқ„ лӮҳнғҖлӮёлӢӨ. к·ё мҷём—җлҸ„ vimentin, ki-67, beta (Гҹ)-catenin л“ұмқҙ мў…м–‘мқ„ м •нҷ•н•ҳкІҢ 진лӢЁн•ҳлҠ” лҚ° лҸ„мӣҖмқ„ мӨ„ мҲҳ мһҲлӢӨ[8]. Chandala л“ұмқҳ м—°кө¬м—җ мқҳн•ҳл©ҙ S-100 proteinмқҖ 94кұҙ мӨ‘ 93кұҙ(98.93%), SMAлҠ” 88кұҙ мӨ‘ 82кұҙ(93.18%)м—җм„ң м–‘м„ұмқҙ лӮҳмҷ”мңјл©°, ліё мҰқлЎҖлҘј нҸ¬н•Ён•ҳм—¬ мҙқ 95кұҙмқҳ кІҖмӮ¬ кІ°кіјлҠ” Table 1кіј к°ҷлӢӨ[1-4,9-12]. ліё мҰқлЎҖмқҳ нҷҳмһҗ лҳҗн•ң S-100 protein, SMA, vimentin, ki-67м—җм„ң м–‘м„ұмқ„ лӮҳнғҖлғҲлӢӨ.
мқјл°ҳм ҒмңјлЎң S-100 proteinкіј SMAмқҳ л°ңнҳ„ л“ұ мЎ°м§Ғ, л©ҙм—ӯн•ҷм Ғ мҶҢкІ¬л§ҢмңјлЎң BSNSлҘј 진лӢЁн• мҲҳ мһҲлӢӨ. к·ёлҹ¬лӮҳ мЎ°м§Ғн•ҷм ҒмңјлЎң BSNSмҷҖ мң мӮ¬н•ҳкұ°лӮҳ л©ҙм—ӯн•ҷм ҒмңјлЎң л№„м „нҳ•м Ғмқё BSNSмқҳ кІҪмҡ°к°Җ мһҲмқ„ мҲҳ мһҲлҠ”лҚ°, мқҙлҠ” fluorescence in situ hybridization (FISH)мқ„ нҶөн•ң PAX3кіј MAML3 мң м „мһҗ мһ¬л°°м—ҙмқҳ нҷ•мқёмқҙ н•„мҡ”н•ҳлӢӨ[13,14]. Jo л“ұ[14]мқҳ м—°кө¬м—җ л”°лҘҙл©ҙ 15к°ңмқҳ BSNS мҰқлЎҖ л°Ҹ мқҙмҷҖ мЎ°м§Ғн•ҷм ҒмңјлЎң мң мӮ¬н•ң м•…м„ұл§җмҙҲмӢ кІҪмҙҲмў…м–‘, нҷңл§үмңЎмў…, 방추세нҸ¬ нҡЎл¬ёк·јмңЎмў…(spindle cell rhabdomyosarcoma), кі лҰҪм„ұ 섬мң мў…, 비л¶Җ비лҸҷ нҳҲкҙҖмЈјмң„м„ёнҸ¬мў…(sinonasal hemangiopericytoma), м„ёнҸ¬м„ұ мӢ кІҪмҙҲмў…м—җ н•ҙлӢ№н•ҳлҠ” к°Ғк°Ғмқҳ 10к°ң мҰқлЎҖлҘј 비көҗн•ҳмҳҖлӢӨ. BSNSм—җ лҢҖн•ң PAX3мқҳ лҜјк°җлҸ„(sensitivity)лҠ” 100% (15/15)лҘј ліҙмҳҖмңјл©°, н•ҳлӮҳмқҳ 방추세нҸ¬ нҡЎл¬ёк·јмңЎмў… мҰқлЎҖлҘј м ңмҷён•ҳл©ҙ мң„мқҳ лӢӨлҘё лӘЁл“ мў…м–‘м—җм„ң PAX3лҠ” мқҢм„ұмңјлЎң, к·ё кІ°кіј BSNSм—җ лҢҖн•ң PAX3мқҳ нҠ№мқҙлҸ„(specificity)лҠ” 98%лЎң нҷ•мқёлҗҳм—ҲлӢӨ. Chitguppi л“ұ[4]мқҳ м—°кө¬м—җ мқҳн•ҳл©ҙ 95кұҙмқҳ BSNS мӨ‘ 63кұҙм—җм„ң FISHлҘј мӢңн–үн•ҳмҳҖкі , к·ё мӨ‘ 3кұҙмқҳ мӢӨн—ҳмӢӨнҢЁлҘј м ңмҷён•ҳл©ҙ PAX3мҷҖ MAML3 лӘЁл‘җ м—ҶлҠ” кІҪмҡ°лҠ” 4кұҙ(6.34%)лҝҗмқҙм—ҲлӢӨ.
м№ҳлЈҢлҠ” мў…м–‘мқҳ мҷёкіјм Ғ м Ҳм ңмқҙл©° мў…м–‘мқҳ м№ЁлІ” лІ”мң„м—җ л”°лқј л‘җк°ңм•Ҳл©ҙм Ҳм ңмҲ (craniofacial resection)мқҙлӮҳ м•Ҳкө¬ м Ғм¶ңмҲ (orbital exenteration)к№Ңм§Җ мӢңн–үн• мҲҳ мһҲмңјл©° мҷёкіјм Ғ м Ҳм ң мқҙнӣ„ л°©мӮ¬м„ м№ҳлЈҢлҘј 추к°ҖлЎң мӢңн–үн• мҲҳ мһҲлӢӨ. Chitguppi л“ұ[4]мқҳ м—°кө¬м—җ мқҳн•ҳл©ҙ м№ҳлЈҢм—җ лҢҖн•ң м •нҷ•н•ң м •ліҙлҘј м•Ң мҲҳ мһҲм—ҲлҚҳ мҙқ 8кұҙм—җм„ң кё°ліём ҒмңјлЎң мҲҳмҲ м Ғ м Ҳм ңлҘј н•ҳмҳҖмңјл©° 2кұҙм—җм„ң 추к°Җм ҒмңјлЎң л°©мӮ¬м„ м№ҳлЈҢк°Җ мқҙлЈЁм–ҙмЎҢлӢӨ. м№ҳлЈҢлҘј мҷ„лЈҢн•ң мқҙнӣ„ 95кұҙ мӨ‘ 34кұҙмқ„ нҸүк· м ҒмңјлЎң 4.61л…„ 추м Ғ кҙҖм°°н•ң кІ°кіј, мһ¬л°ңлҘ мқҖ 11кұҙ(32%)мқҙм—Ҳмңјл©° мһ¬л°ңк№Ңм§Җ нҸүк· кё°к°„мқҖ 2.4л…„мқҙм—ҲлӢӨ. к·ёлҹ¬лӮҳ 추м Ғ кҙҖм°°н•ң лӘЁл“ кІҪмҡ°м—җм„ң мӣҗкІ©м „мқҙ мҶҢкІ¬мқҖ л°ңкІ¬лҗҳм§Җ м•Ҡм•ҳлӢӨ. лҳҗн•ң м§ҖкёҲк№Ңм§Җ мқҙ мў…м–‘мңјлЎң мқён•ҙ мӮ¬л§қн•ң кІҪмҡ°лҠ” 1к°ңмқҳ мҰқлЎҖ л°–м—җ ліҙкі лҗҳм§Җ м•Ҡм•ҳлӢӨ[4,8]. к·ёлҹ¬лӮҳ мқҙ мҳҲнӣ„м—җ кҙҖл Ён•ң лҚ°мқҙн„°лҠ” мһ„мғҒм Ғ 추м Ғ кҙҖм°°мқҙ мқҙлЈЁм–ҙм§Җм§Җ м•ҠмқҖ мҲҳл§ҺмқҖ мҰқлЎҖлЎң мқён•ҙ м ңн•ңм ҒмқҙлӢӨ[1,4,8]. ліё мҰқлЎҖ лҳҗн•ң 추м Ғ кҙҖм°° кё°к°„мқҖ м•„м§Ғ 8к°ңмӣ”мқҙл©° мҲҳмҲ н•ң л¶Җмң„мқҳ мһ¬л°ң л°Ҹ м „мқҙ мҶҢкІ¬мқҖ ліҙмқҙм§Җ м•ҠмңјлӮҳ 충분н•ң кҙҖм°° кё°к°„мқҙ н•„мҡ”н•ҳлӢӨ.
BSNSлҠ” 2017л…„ л°ңк°„лҗң м„ёкі„ліҙкұҙкё°кө¬ л‘җкІҪл¶Җ мў…м–‘ 분лҘҳ 4нҢҗ(the fourth edition of the World Health Organization Classification of Head and Neck Tumours)м—җ нҸ¬н•Ёлҗҳм—Ҳмңјл©°[15], ліё мҰқлЎҖлҠ” көӯлӮҙм—җм„ң мІҳмқҢ ліҙкі н•ң мҰқлЎҖмқҙлӢӨ. м§ҖкёҲк№Ңм§Җ м—°кө¬лҗң л°”м—җ л”°лҘҙл©ҙ BSNSлҠ” мӣҗкІ©м „мқҙмқҳ к°ҖлҠҘм„ұмқҖ лӮ®м§Җл§Ң лҶ’мқҖ мһ¬л°ңлҘ л°Ҹ лӢӨлҘё мЈјмң„ кө¬мЎ°л¬ј м№ЁлІ”мқҳ к°ҖлҠҘм„ұмңјлЎң мІ м Җн•ң мҷёлһҳ 추м Ғ л°Ҹ кҙҖм°°мқ„ мҡ”н•ңлӢӨ.
NotesAuthor Contribution Conceptualization: Woo Yong Bae. Investigation: Young Gun Kim, Jae Won Heo. Resources: Young Gun Kim, Jae Won Heo, Song-Hee Han. WritingвҖ”original draft: Young Gun Kim. WritingвҖ”review & editing: Woo Yong Bae, Young Gun Kim. Fig.В 2.Preoperative radiologic findings. CT findings. Hypervascular mass at left posterior nasal cavity. Axial view (A), coronal view (B), saggital view (C), and non-enhanced view (D). 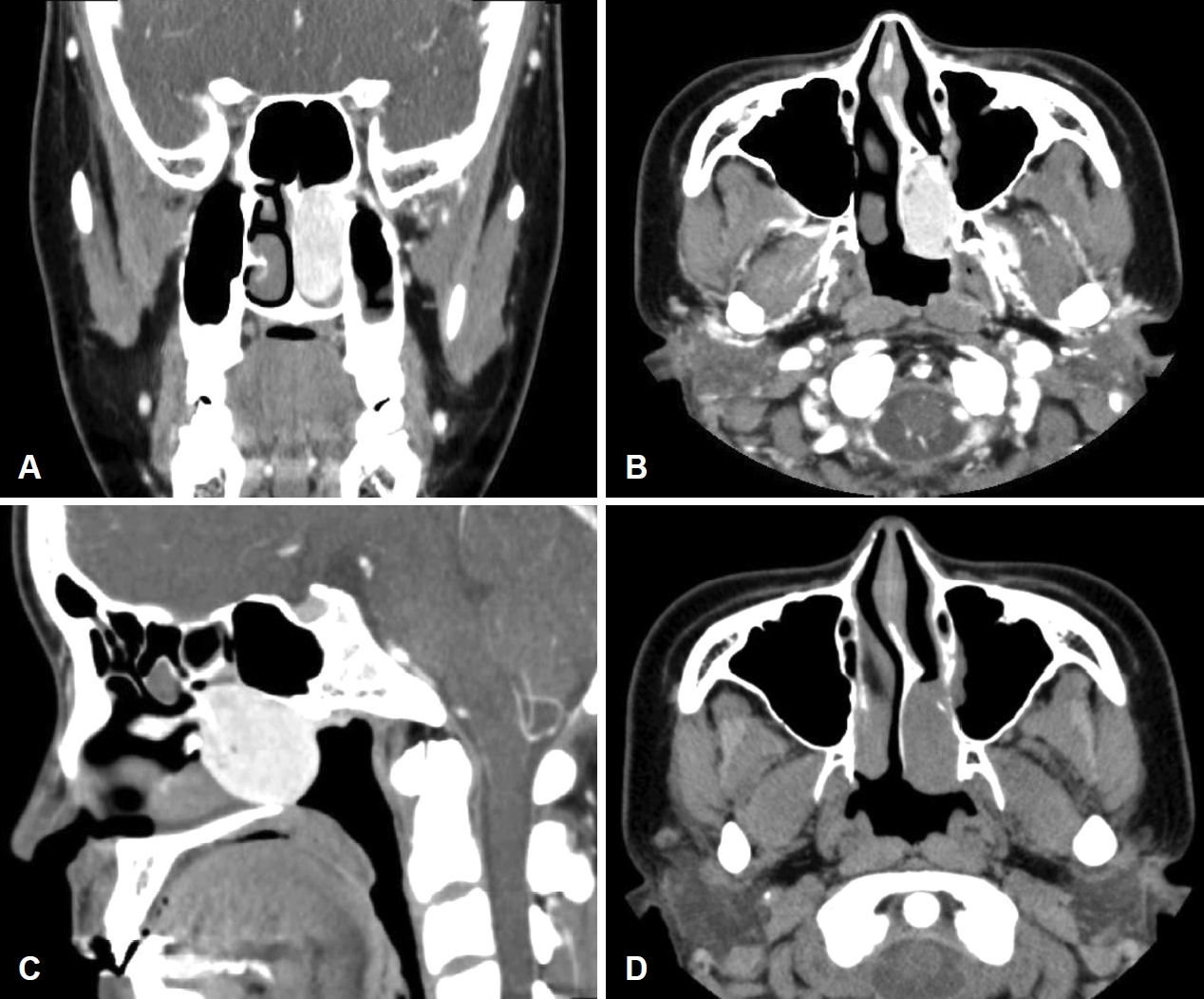
Fig.В 3.Preoperative radiologic findings. MRI findings. T2 axial view (A), T2 coronal view (B), T1 axial view (C), and T1 coronal view (D). 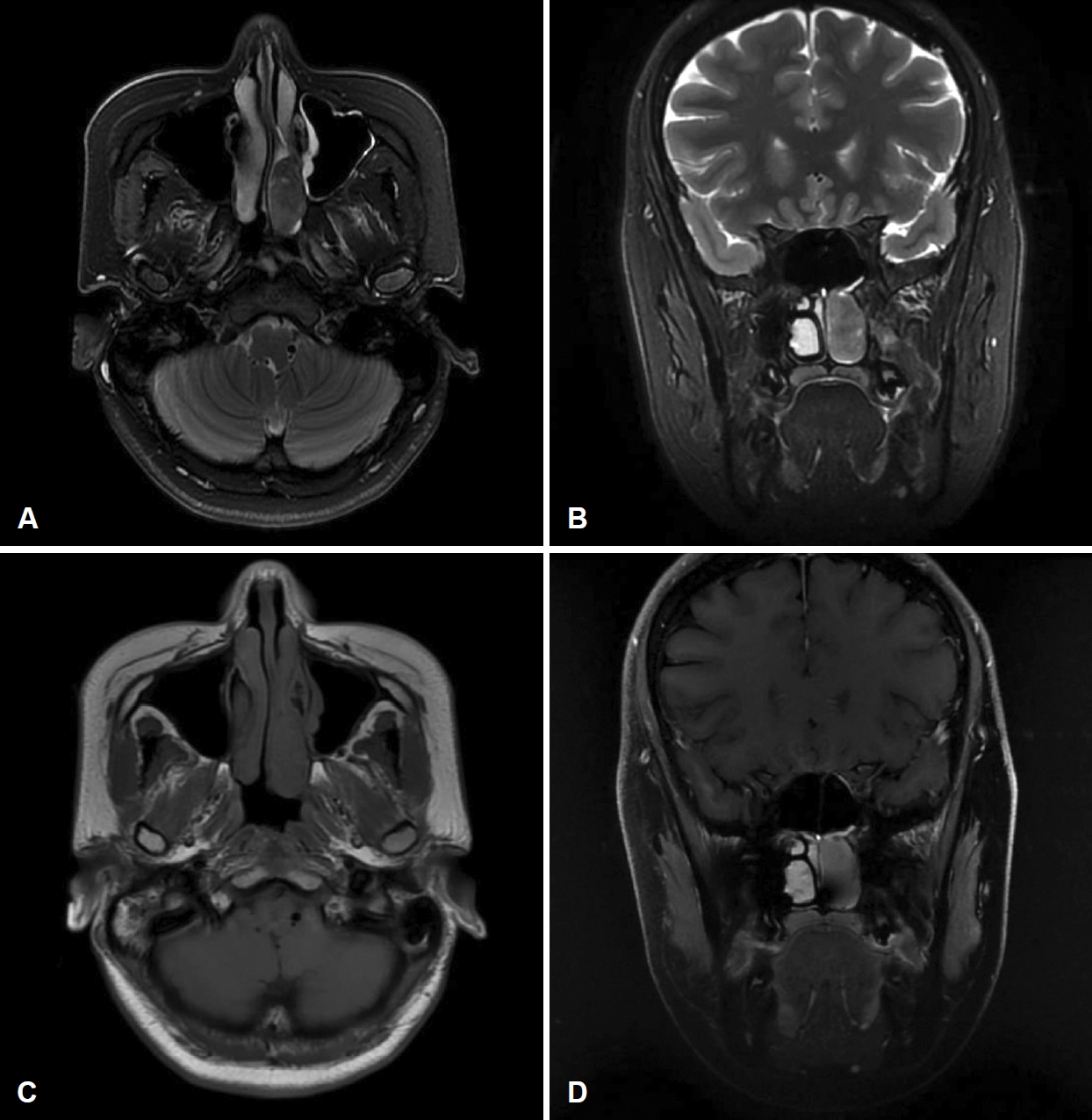
Fig.В 4.Left external carotid artery angiography. The tumor blush at the posterior nasal cavity (A and B). After polyvinyl alcohol embolization through internal maxillary artery the tumor disappeared (C and D). 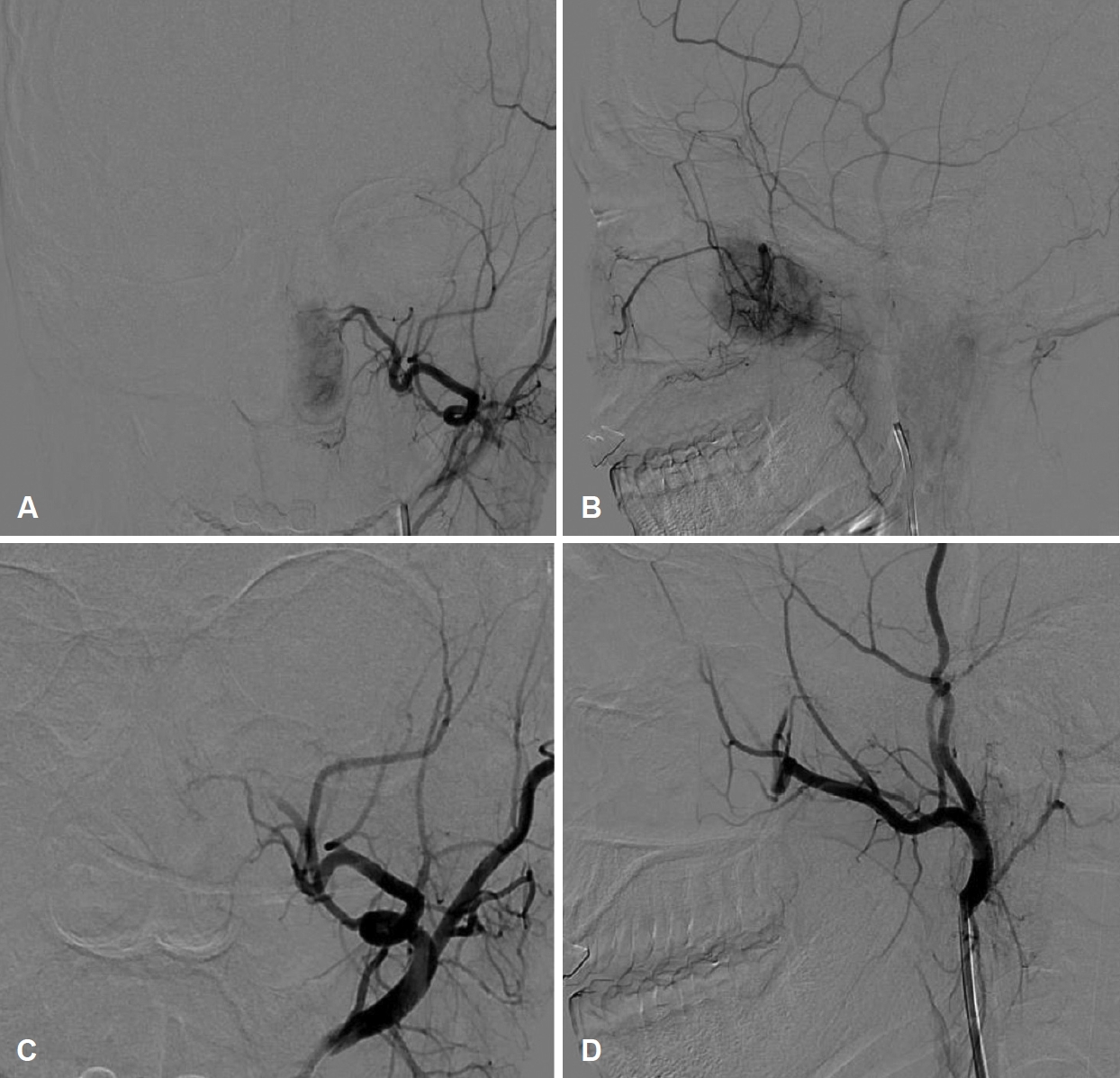
Fig.В 5.Histopathological findings. The spindle cells growing and infiltrating with high cell density inside the stroma of the nasal mucous membrane (A: H&E, Г—10; B: H&E, Г—20). The tumor cells are diffusely immunoreacive for S-100 protein (C: S-100, Г—10) and SMA (D: SMA, Г—10). H&E, hematoxylin and eosin; SMA, smooth muscle actin. 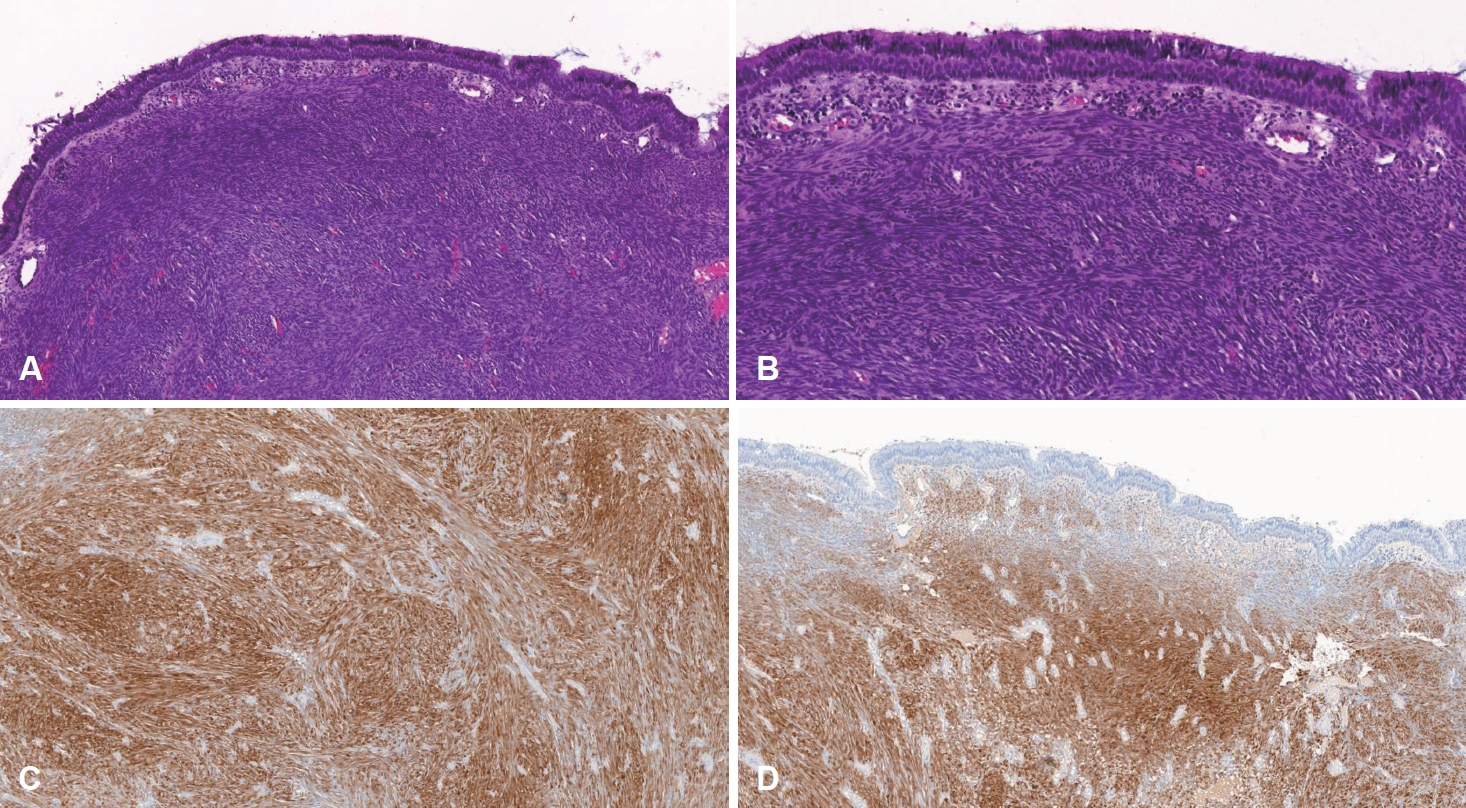
Fig.В 6.Endoscopic exam. Postoperative nasal endoscopic findings at left nasal cavity. POD 3 days (A), POD 1 month (B), POD 5 months (C). POD, post operative day. 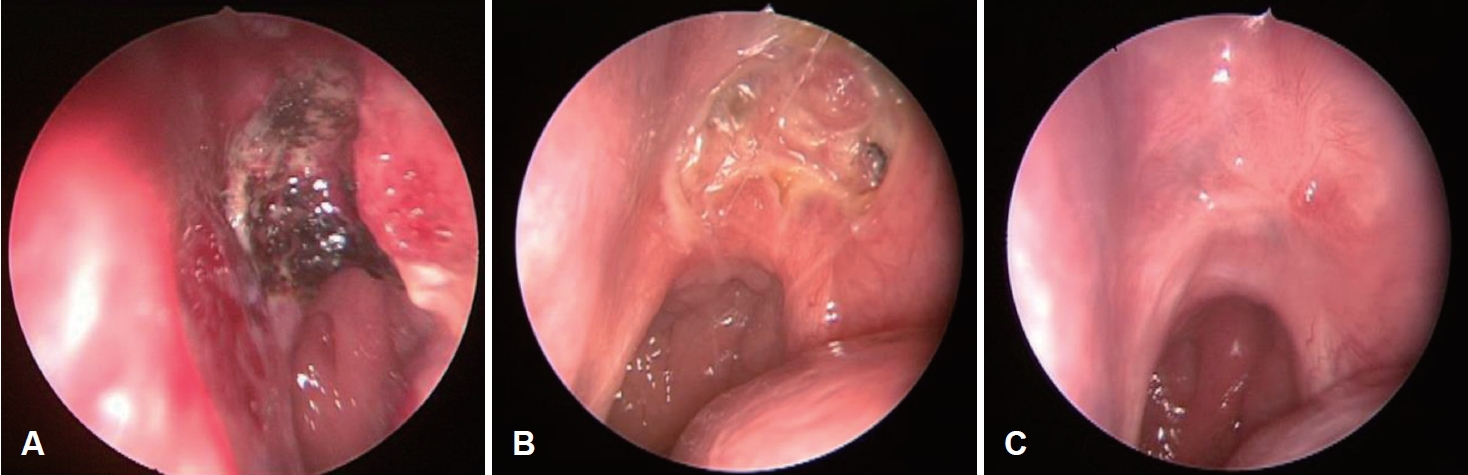
TableВ 1.Details of immunophenotyping studies REFERENCES1. Lewis JT, Oliveira AM, Nascimento AG, Schembri-Wismayer D, Moore EA, Olsen KD, et al. Low-grade sinonasal sarcoma with neural and myogenic features: A clinicopathologic analysis of 28 cases. Am J Surg Pathol 2012;36(4):517-25.
2. Cannon RB, Wiggins RH 3rd, Witt BL, Dundar Y, Johnston TM, Hunt JP. Imaging and outcomes for a new entity: Low-grade sinonasal sarcoma with neural and myogenic features. J Neurol Surg Rep 2017;78(1):e15-9.
3. Huang SC, Ghossein RA, Bishop JA, Zhang L, Chen TC, Huang HY, et al. Novel PAX3-NCOA1 fusions in biphenotypic sinonasal sarcoma with focal rhabdomyoblastic differentiation. Am J Surg Pathol 2016;40(1):51-9.
4. Chitguppi C, Koszewski I, Collura K, Curtis M, Nyquist G, Rabinowitz M, et al. Biphenotypic sinonasal sarcoma-case report and review of clinicopathological features and diagnostic modalities. J Neurol Surg B Skull Base 2019;80(1):51-8.
5. Miglani A, Lal D, Weindling SM, Wood CP, Hoxworth JM. Imaging characteristics and clinical outcomes of biphenotypic sinonasal sarcoma. Laryngoscope Investig Otolaryngol 2019;4(5):484-8.
6. Lee DK, Chung SK, Dhong HJ, Kim HY, Kim HJ, Bok KH. Focal hyperostosis on CT of sinonasal inverted papilloma as a predictor of tumor origin. AJNR Am J Neuroradiol 2007;28(4):618-21.
7. Chiu AG, Jackman AH, Antunes MB, Feldman MD, Palmer JN. Radiographic and histologic analysis of the bone underlying inverted papillomas. Laryngoscope 2006;116(9):1617-20.
8. Pieper DR, Al-Mefty O, Hanada Y, Buechner D. Hyperostosis associated with meningioma of the cranial base: Secondary changes or tumor invasion. Neurosurgery 1999;44(4):742-6, discussion 746-7.
9. Wong WJ, Lauria A, Hornick JL, Xiao S, Fletcher JA, Marino-Enriquez A. Alternate PAX3-FOXO1 oncogenic fusion in biphenotypic sinonasal sarcoma. Genes Chromosomes Cancer 2016;55(1):25-9.
10. Fritchie KJ, Jin L, Wang X, Graham RP, Torbenson MS, Lewis JE, et al. Fusion gene profile of biphenotypic sinonasal sarcoma: An analysis of 44 cases. Histopathology 2016;69(6):930-6.
11. Rooper LM, Huang SC, Antonescu CR, Westra WH, Bishop JA. Biphenotypic sinonasal sarcoma: An expanded immunoprofile including consistent nuclear ОІ-catenin positivity and absence of SOX10 expression. Hum Pathol 2016;55:44-50.
12. Powers KA, Han LM, Chiu AG, Aly FZ. Low-grade sinonasal sarcoma with neural and myogenic features--diagnostic challenge and pathogenic insight. Oral Surg Oral Med Oral Pathol Oral Radiol 2015;119(5):e265-9.
13. Wang X, Bledsoe KL, Graham RP, Asmann YW, Viswanatha DS, Lewis JE, et al. Recurrent PAX3-MAML3 fusion in biphenotypic sinonasal sarcoma. Nat Genet 2014;46(7):666-8.
|
|
||||||||||||||||||||||||||||||||||||||||||||

 |
 |