 |
 |
AbstractBackground and ObjectivesFew studies have been reported on the strains that cause postoperative infection after chronic otitis media (COM) surgery. This study examined the direction of empirical antibiotics selection for patients with postoperative infection.
Subjects and MethodThis was a retrospective study of 33 patients who were admitted for antibiotics therapy after suffering intractable post-operative infection of COM surgery at Chonnam National University Hospital from 2011 to 2021. Demographic data and microbial culture results of pre-operation and post-operative infection, as well as selected antibiotics for different time periods were evaluated.
ResultsMost common pathologic organisms responsible for post-operative infection were Methicillin-resistant Staphylococcus aureus (MRSA) (45.5%) and Ciprofloxacin-resistant Pseudomonas aeruginosa (CRPA) (12.1%). Interestingly, there were only three cases where pre- and post-operative culture tests were the same, testing positive for two MRSA and one CRPA. The antibiotics selected as empirical antibiotics for postoperative infection were ceftazidime (48.5%) and vancomycin (27.3%). The rate of the cases where the selected empirical antibiotic was sensitive to the strain was 63.6%, and the rate of changing the antibiotics according to the microbial culture test result was 39.4%.
ConclusionThe strains cultured from the otorrhea of post-operatively infected patients had a very high ratio of drug-resistant strains and were different from the strains cultured from the otorrhea before surgery. Therefore, a microbial culture test is essential when an infection occurs after surgery, and regardless of the preoperative culture test results, patients with intractable postoperative infections should be treated with empirical vancomycin.
м„ң лЎл§Ңм„ұ мӨ‘мқҙм—јм—җм„ң н•©лі‘мҰқкіј мһ¬л°ңмқ„ мӨ„мқҙкі м Ғм Ҳн•ң м№ҳлЈҢлҘј мӢңн–үн•ҳкё° мң„н•ҙм„ңлҠ” нҡЁкіјм Ғмқё н•ӯмғқм ңлҘј мӮ¬мҡ©н•ҳлҠ” кІғмқҙ н•„мҲҳм ҒмқҙлӢӨ. н•ӯмғқ л¬јм§Ҳмқҳ к°ңл°ңкіј н•Ёк»ҳ мқҙм—җ лҢҖн•ң лӮҙм„ұк· мқҙ м—°мқҙм–ҙ м¶ңнҳ„н•ҳкі м„ёк· мҙқмқҳ ліҖнҷ”лҸ„ кі„мҶҚн•ҙм„ң мқјм–ҙлӮҳкі мһҲлӢӨ. к·ёлһҳм„ң ліҖнҷ”н•ҳлҠ” м„ёк· мҙқм—җ лҢҖн•ң м •ліҙмҷҖ м„ёк· кІҖмӮ¬к°Җ м Ғм Ҳн•ң н•ӯмғқм ңлҘј м„ нғқн•ҳлҠ” лҚ° н•„мҲҳм ҒмқҙлӢӨ[1]. мқҙм—җ лҢҖн•ҙ к·ёлҸҷм•Ҳ л§ҺмқҖ м Җмһҗл“Өмқҙ л§Ңм„ұ нҷ”лҶҚм„ұ мӨ‘мқҙм—јм—җ лҢҖн•ң м„ёк· н•ҷм Ғмқё кі м°°мқ„ мӢңн–үн•ҳм—¬ мҷ”мңјлӮҳ[2,3], л§Ңм„ұ мӨ‘мқҙм—јм—җ лҢҖн•ң мҲ нӣ„ к°җм—јмқҙ л°ңмғқн•ң нҷҳмһҗмқҳ мқҙлЈЁм—җ лҢҖн•ң м„ёк· н•ҷм Ғмқё м—°кө¬лҠ” л“ңл¬ё мӢӨм •мқҙлӢӨ. мқҙм—җ л”°лқј ліё м—°кө¬м—җм„ңлҠ” мҲ нӣ„ к°җм—ј нҷҳмһҗм—җкІҢм„ң л°°м–‘лҗң к· мЈјмқҳ мў…лҘҳлҘј мЎ°мӮ¬н•ҳм—¬ мҙҲкё° н•ӯмғқм ң м„ нғқм—җ лҢҖн•ң л°©н–Ҙм„ұмқ„ кі м°°н•ҙліҙкі мһҗ н•ҳмҳҖлӢӨ.
лҢҖмғҒ л°Ҹ л°©лІ•лҢҖ мғҒ2012л…„ 1мӣ”л¶Җн„° 2021л…„ 9мӣ”к№Ңм§Җ л§Ңм„ұ мӨ‘мқҙм—јм—җ лҢҖн•ң мҲҳмҲ м Ғ м№ҳлЈҢ мӢңн–ү нӣ„ 2к°ңмӣ” мқҙлӮҙм—җ к°җм—јмқҙ л°ңмғқн•ҳм—¬ нҶөмӣҗ м№ҳлЈҢм—җлҸ„ л¶Ҳкө¬н•ҳкі м—јмҰқмқҙ нҳём „лҗҳм§Җ м•Ҡм•„ м „лӮЁлҢҖн•ҷкөҗлі‘мӣҗ мқҙ비мқёнӣ„кіјм—җ мһ…мӣҗн•ҳм—¬ н•ӯмғқм ң м№ҳлЈҢлҘј мӢңн–үн•ң нҷҳмһҗл“Өмқҳ мқҳл¬ҙкё°лЎқмқ„ нӣ„н–Ҙм ҒмңјлЎң 분м„қн•ҳмҳҖлӢӨ. 10л…„ лҸҷм•Ҳ мҙқ 33лӘ…мқҳ нҷҳмһҗл“Өмқҙ мһ…мӣҗн•ҳм—¬ н•ӯмғқм ң м№ҳлЈҢлҘј мӢңн–ү л°ӣм•ҳлӢӨ. н‘ңліёмқ„ лҢҖмғҒмңјлЎң мҲ м „ 진лӢЁлӘ…, м„ұлі„, лӮҳмқҙ, кё°м Җ м§Ҳнҷҳ мң л¬ҙ(кі нҳҲм••, лӢ№лҮЁ)лҘј нҷ•мқён•ҳмҳҖлӢӨ.
мҲҳмҲ м „ лі‘мқҳ 진лӢЁлӘ…мңјлЎңлҠ” л§Ңм„ұ нҷ”лҶҚм„ұ мӨ‘мқҙм—јмқҙ 19кұҙмңјлЎң к°ҖмһҘ л§Һм•ҳкі , 진주종м„ұ мӨ‘мқҙм—јмқҙ 13кұҙ, мң м°©м„ұ мӨ‘мқҙм—ј 1кұҙмңјлЎң нҷ•мқёлҗҳм—ҲлӢӨ(Table 1).
мҙқ 33лӘ…мқҳ нҷҳмһҗкө° мӨ‘ лӮЁмһҗлҠ” 11лӘ…(33.3%), м—¬мһҗлҠ” 22лӘ…(66.7%)мқҙм—ҲлӢӨ. нҸүк· лӮҳмқҙлҠ” 47.5м„ё(Вұ34.5)лЎң 10лҢҖлҠ” 1лӘ…(3%), 20лҢҖлҠ” 0лӘ…(0%), 30лҢҖлҠ” 2лӘ…(6.1%), 40лҢҖлҠ” 5лӘ…(15.2%), 50лҢҖлҠ” 7лӘ…(21.2%), 60лҢҖлҠ” 9лӘ…(27.3%), 70лҢҖлҠ” 8лӘ…(24.2%), 80лҢҖлҠ” 1лӘ…(3%)мқҳ 분нҸ¬лҘј ліҙмқҙкі мһҲм—ҲлӢӨ(Fig. 1).
кё°м Җ м§Ҳнҷҳ л°Ҹ мғҒнғңлЎңлҠ” кі нҳҲм•• 5лӘ…(15.2%), лӢ№лҮЁ 3лӘ…(9.1%)мңјлЎң мЎ°мӮ¬лҗҳм—ҲлӢӨ.
л°© лІ•нҷҳмһҗкө°мқ„ лҢҖмғҒмңјлЎң мҲ м „ лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬ м—¬л¶Җ, мҲҳмҲ нӣ„ мӮ¬мҡ©н•ң 1м°Ё н•ӯмғқм ң, мҲ нӣ„ к°җм—ј л°ңмғқ нӣ„ мӢңн–үн•ң лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬м—җм„ң л°°м–‘лҗң к· мЈјмқҳ мў…лҘҳ, мҲ нӣ„ к°җм—ј л°ңмғқ мӢң мҙҲкё° м„ нғқн•ң 2м°Ё кІҪн—ҳм Ғ н•ӯмғқм ң, л°°м–‘ кІҖмӮ¬ кІ°кіјм—җ л”°лқј ліҖкІҪн•ң 3м°Ё н•ӯмғқм ңлҘј нҷ•мқён•ҳмҳҖлӢӨ. мҙқ м№ҳлЈҢ кё°к°„мқҖ мһ…мӣҗ кё°к°„ лҸҷм•Ҳ н•ӯмғқм ңлҘј мӮ¬мҡ©н•ң мҙқ мқј мҲҳлЎң м •мқҳн•ҳмҳҖлӢӨ. н•ӯмғқм ң нҲ¬м—¬ мў…лЈҢ кё°мӨҖмқҖ н•ӯмғқм ң мӮ¬мҡ© нӣ„м—җ нҷҳмһҗмқҳ мһ„мғҒ мҰқмғҒ(мқҙнҶө, л‘җнҶө, м—ҙк°җ л“ұ)кіј 징нӣ„(мқҙлЈЁ, лҙүн•© л¶Җмң„ мӮјм¶ңл¬ј, мў…м°Ҫ л°Ҹ л°ңм Ғ, м—јмҰқ мҲҳм№ҳ)мқҳ нҳём „мқ„ мў…н•©м ҒмңјлЎң нҢҗлӢЁн•ҳм—¬ мў…лЈҢ мӢңм җмқ„ кІ°м •н•ҳмҳҖлӢӨ.
кІҖмІҙ мұ„м·ЁлҠ” мҷёмқҙлҸ„ лҳҗлҠ” мҲ нӣ„ м°ҪмғҒ лӮҙл¶Җмқҳ мӮјм¶ңл¬јм—җ лҢҖн•ҙ мЈјмң„ н”јл¶ҖмҷҖ м ‘мҙүмқ„ л°©м§Җн•ҳл©ҙм„ң л©ёк· лҗң л©ҙлҙүмңјлЎң мӢңн–үн•ҳмҳҖмңјл©°, TransystemTM sterile transport swab (COPAN Diagnostics, Murrieta, CA, USA)мқ„ мӮ¬мҡ©н•ҳмҳҖлӢӨ.
нҶөкі„ 분м„қнҶөкі„ 분м„қмқҖ нҶөкі„ 분м„қ н”„лЎңк·ёлһЁ R (ver. 4.1.2)мқ„ мқҙмҡ©н•ҳм—¬ мӢңн–үн•ҳмҳҖлӢӨ. мҲ нӣ„ к°җм—ј л°ңмғқ нӣ„ кІҪн—ҳм Ғ н•ӯмғқм ңлЎң vancomycinмқ„ м„ нғқн–Ҳмқ„ л•ҢмҷҖ ceftazidimeмқ„ м„ нғқн–Ҳмқ„ л•Ң мҙқ м№ҳлЈҢ кё°к°„мқҳ м°ЁмқҙлҘј лҸ…лҰҪ н‘ңліё TкІҖм •мқ„ мӮ¬мҡ©н•ҳм—¬ кІҖм •н•ҳмҳҖлӢӨ. лҳҗн•ң мҲ нӣ„ к°җм—ј л°ңмғқ нӣ„ мӢңн–үн•ң л°°м–‘ кІҖмӮ¬мғҒ Methicillin-resistant Staphylococcus aureus (MRSA)к°Җ кІҖм¶ңлҗҳм—Ҳмқ„ л•ҢмҷҖ Ciprofloxacin-resistant Pseudomonas aeruginosa (CRPA)к°Җ кІҖм¶ңлҗҳм—Ҳмқ„ л•Ң мҙқ м№ҳлЈҢ кё°к°„мқҳ м°ЁмқҙлҘј лҸ…лҰҪ н‘ңліё TкІҖм •мқ„ мӮ¬мҡ©н•ҳм—¬ кІҖм •н•ҳмҳҖлӢӨ. л§Ҳм§Җл§үмңјлЎң мҲ нӣ„ к°җм—ј л°ңмғқ нӣ„ мӢңн–үн•ң л°°м–‘ кІҖмӮ¬м—җм„ң MRSAк°Җ кІҖм¶ңлҗҳм—Ҳмқ„ л•Ң, мІҳмқҢл¶Җн„° vancomycinмқ„ мӮ¬мҡ©н•ң кө°мқҳ м№ҳлЈҢ кё°к°„кіј л°°м–‘ кІҖмӮ¬к°Җ лӮҳмҳЁ л’Ө н•ӯмғқм ңлҘј vancomycin, teicoplaninмңјлЎң көҗмІҙн•ң кө°мқҳ м№ҳлЈҢ кё°к°„мқ„ лҸ…лҰҪ н‘ңліё TкІҖм •мқ„ мӮ¬мҡ©н•ҳм—¬ кІҖм •н•ҳмҳҖлӢӨ. к°Ғ 분м„қм—җм„ң pк°’мқҙ 0.05 лҜёл§Ңмқё кІҪмҡ° нҶөкі„м ҒмңјлЎң мң мқҳн•ң кІғмңјлЎң м •мқҳн•ҳмҳҖлӢӨ. ліё м—°кө¬лҠ” м „лӮЁлҢҖн•ҷкөҗлі‘мӣҗ мһ„мғҒ м—°кө¬мӢ¬мқҳмң„мӣҗнҡҢ(IRB)мқҳ м—°кө¬ мҠ№мқё(BTMP-2023-044) нӣ„м—җ мҲҳн–үлҗҳм—ҲлӢӨ.
кІ° кіјмҲ м „ лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬ м—¬л¶ҖмҲ м „ лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬к°Җ мӢңн–үлҗң кІҪмҡ°лҠ” мҙқ 14кұҙмқҙм—Ҳмңјл©°, Methicillin resistant Staphylococcus мў…лҘҳк°Җ 4кұҙ(12.12%)мңјлЎң к°ҖмһҘ л§Һм•ҳкі , CRPAмҷҖ Proteus mirabilisк°Җ к°Ғк°Ғ 2кұҙ(6.06%), Ciprofloxacin susceptible Pseudomonas aeruginosa (CSPA)мҷҖ Coagulase-negative Staphylococcus (CoNS)к°Җ к°Ғк°Ғ 1кұҙ(3.03%)мңјлЎң л’ӨлҘј мқҙм—ҲлӢӨ. лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬лҘј мӢңн–үн–ҲмңјлӮҳ к· мЈјк°Җ мһҗлқјм§Җ м•ҠмқҖ кІҪмҡ°лҠ” мҙқ 4кұҙ(12.12%)мқҙм—Ҳмңјл©°, лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬к°Җ мӢңн–үлҗҳм§Җ м•ҠмқҖ кІҪмҡ°лҠ” 17кұҙ(51.51%)мңјлЎң нҷ•мқёлҗҳм—ҲлӢӨ.
мҲ нӣ„ к°җм—ј л°ңмғқ нӣ„ мӢңн–үн•ң лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬ л°Ҹ к· мЈјмқҳ мў…лҘҳ33лӘ…мқҳ мҲ нӣ„ к°җм—ј нҷҳмһҗ мӨ‘ 29лӘ…м—җкІҢм„ң мҲ нӣ„ лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬к°Җ мӢңн–үлҗҳм—ҲлӢӨ. л°°м–‘ кұҙмҲҳ 29кұҙ мӨ‘ м„ёк· мқҙ л°°м–‘лҗң кІҪмҡ°лҠ” 20кұҙ, м§„к· мқҙ л°°м–‘лҗң кІҪмҡ°лҠ” 6кұҙмқҙм—Ҳкі , к· мЈјк°Җ кІҖм¶ңлҗҳм§Җ м•ҠмқҖ кІҪмҡ°лҠ” 3кұҙмқҙм—ҲлӢӨ. 4лӘ…мқҳ нҷҳмһҗм—җкІҢм„ңлҠ” лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬ м—Ҷмқҙ кІҪн—ҳм Ғ н•ӯмғқм ңк°Җ м№ҳлЈҢм—җ мӮ¬мҡ©лҗҳм—ҲлӢӨ.
к· мЈјк°Җ л°°м–‘лҗң 26кұҙмқҳ кІҖмӮ¬ мӨ‘ мҙқ 3к°Җм§Җ мў…мқҳ м„ёк· кіј 2к°Җм§Җ мў…мқҳ м§„к· мқҙ кІҖм¶ңлҗҳм—ҲлӢӨ. мқҙ мӨ‘ MRSA 15кұҙ(45.45%), CRPA 4кұҙ(12.12%), Enterobacter 1кұҙ(0.30%) мҲңмңјлЎң нҷ•мқёлҗҳм—ҲлӢӨ. м§„к· мңјлЎңлҠ” Candida 5кұҙ(15.15%), Aspergillus 1кұҙ(0.30%)мқҙ нҷ•мқёлҗҳм—ҲлӢӨ(Table 2).
лҳҗн•ң мҲ м „ лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬м—җм„ң лҸҷм •лҗң к· мЈјмҷҖ мҲ нӣ„ к°җм—ј нӣ„ лҸҷм •лҗң к· мЈјк°Җ мқјм№ҳн–ҲлҚҳ кІҪмҡ°лҠ” мҙқ 3кұҙм—җ л¶Ҳкіјн–ҲлӢӨ(Fig. 2).
мҲ нӣ„ к°җм—ј л°ңмғқ мӢң мҙҲкё° м„ нғқн•ң кІҪн—ҳм Ғ н•ӯмғқм ңмҲ нӣ„ к°җм—ј л°ңмғқ мӢң мҙҲкё° м„ нғқн•ң н•ӯмғқм ңлҠ” ceftazidimeмқҙ 16кұҙ(48.48%)лЎң к°ҖмһҘ л§Һм•ҳкі , vancomycinмқҙ 9кұҙ(27.27%), flomoxefмҷҖ ceftriaxoneмқҙ к°Ғк°Ғ 2кұҙ(6.06%), gemifloxacin, ertapenem, sulfamethoxazole-trimethoprim, piperacillintazobactamмқҙ к°Ғк°Ғ 1кұҙ(3.03%)м”© мӮ¬мҡ©лҗҳм—ҲлӢӨ(Table 3).
л°°м–‘ кІҖмӮ¬ кІ°кіјм—җ л”°лқј ліҖкІҪн•ң 2м°Ё н•ӯмғқм ңмҲ нӣ„ к°җм—ј нӣ„ мӢңн–үн•ң лҜёмғқл¬ј кІҖмӮ¬м—җм„ң л°°м–‘лҗң к· мЈјк°Җ MRSA лҳҗлҠ” CRPA л“ұ кІҪн—ҳм Ғ н•ӯмғқм ңм—җ к°җмҲҳм„ұмқҙ м—ҶлҠ” кІғмңјлЎң нҷ•мқёлҗң кІҪмҡ°м—җлҠ” к· мЈјм—җ к°җмҲҳм„ұмқҙ мһҲлҠ” н•ӯмғқм ңлЎң ліҖкІҪмқ„ мӢңн–үн•ҳмҳҖмңјл©°, мқҙмҷёмқҳ к· мЈјк°Җ лҸҷм •лҗҳм—Ҳмқ„ кІҪмҡ°м—җлҠ” кё°мЎҙ кІҪн—ҳм Ғ н•ӯмғқм ң мӮ¬мҡ©мқ„ м§ҖмҶҚн•ҳмҳҖлӢӨ(Fig. 3).
мҲ нӣ„ к°җм—ј л°ңмғқ мӢң н•ӯмғқм ң мӮ¬мҡ©мқј мҲҳк°Ғ к· мЈјлі„лЎң н•ӯмғқм ң м№ҳлЈҢ кё°к°„мқҖ л°°м–‘ кІҖмӮ¬м—җм„ң лҸҷм •лҗң к· мЈјк°Җ MRSAмқј кІҪмҡ° мҙқ м№ҳлЈҢ кё°к°„мқҖ нҸүк· 15.33мқјмқҙ мҶҢмҡ”лҗҳм—Ҳкі CRPAлҠ” нҸүк· 12.00мқјмқҙ мҶҢмҡ”лҗҳм—Ҳмңјл©°, л‘җ кө°к°„ нҶөкі„м ҒмңјлЎң мң мқҳлҜён•ң м°ЁмқҙлҠ” ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ(p=0.379) (Table 4).
лҳҗн•ң мҲ нӣ„ к°җм—ј л°ңмғқ нӣ„ кІҪн—ҳм Ғ н•ӯмғқм ңлЎң vancomycinмқ„ м„ нғқн–Ҳмқ„ л•Ңмқҳ мҙқ м№ҳлЈҢ кё°к°„мқҖ нҸүк· 10.67мқј, ceftazidimeмқ„ м„ нғқн–Ҳмқ„ л•ҢлҠ” нҸүк· 13.06мқјмқҙ мҶҢмҡ”лҗҳм—Ҳмңјл©° л‘җ кө°к°„ нҶөкі„м ҒмңјлЎң мң мқҳлҜён•ң м°ЁмқҙлҠ” ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ(p=0.329) (Table 5).
л§Ҳм§Җл§үмңјлЎң мҲ нӣ„ к°җм—ј л°ңмғқ нӣ„ мӢңн–үн•ң л°°м–‘ кІҖмӮ¬м—җм„ң MRSAк°Җ кІҖм¶ңлҗҳм—Ҳмқ„ л•Ң мІҳмқҢл¶Җн„° кІҪн—ҳм Ғ н•ӯмғқм ңлҘј vancomycinмңјлЎң мӮ¬мҡ©н•ң кө°мқҳ мҙқ м№ҳлЈҢ кё°к°„мқҖ нҸүк· 10.17мқјлЎң, лӢӨлҘё кІҪн—ҳм Ғ н•ӯмғқм ңлҘј мӮ¬мҡ©н•ҳлӢӨк°Җ л°°м–‘ кІҖмӮ¬к°Җ лӮҳмҳЁ л’Ө н•ӯмғқм ңлҘј vancomycin, teicoplaninмңјлЎң көҗмІҙн•ң кө°мқҳ мҙқ м№ҳлЈҢ кё°к°„мқё нҸүк· 18.78мқјм—җ 비н•ҙ нҶөкі„м ҒмңјлЎң мң мқҳлҜён•ҳкІҢ 짧мқҖ кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ(p=0.003) (Table 4).
кі м°°ліё м—°кө¬м—җм„ң лҢҖмғҒм—җ нҸ¬н•Ёлҗң мҙқ 33лӘ…мқҳ нҷҳмһҗ мӨ‘ л°°м–‘ кІҖмӮ¬лҘј мӢңн–үн•ң нҷҳмһҗ мҲҳлҠ” 29лӘ…мқҙм—ҲлӢӨ. мқҙ мӨ‘ лҢҖлӢӨмҲҳлҠ” н•ӯмғқм ң лӮҙм„ұ к· мЈјмқё MRSA, CRPA л“ұмқҙ кІҖм¶ңлҗҳм—ҲлӢӨ. 6кұҙ(18.18%)м—җм„ңлҠ” м§„к· мқҙ кІҖм¶ңлҗҳм—Ҳкі , 4кұҙ(12.12%)м—җм„ң к· мқҙ кІҖм¶ңлҗҳм§Җ м•Ҡм•ҳлӢӨ. мқҙмІҳлҹј мқҙлЈЁм—җ лҢҖн•ң м„ёк· л°°м–‘мқҙ лҗҳм§Җ м•ҠмқҖ мқҙмң лЎңлҠ” мҲ м „ н•ӯмғқм ңмқҳ мһҘкё°м Ғмқё мӮ¬мҡ©мңјлЎң м •к· мғҒнғңк°Җ лҗҳм–ҙ лі‘мӣҗк· мқҳ мҰқмӢқ л°Ҹ м„ұмһҘмқҙ лҠҗл Өм§Җкұ°лӮҳ, мІңмІңнһҲ мҰқмӢқн•ҳлҠ” лі‘мқёк· мқҙ к°җм—јмқҳ мӣҗмқёмқё кІҪмҡ°лҘј мғқк°Ғн•ҙліј мҲҳ мһҲлӢӨ[4].
мҷёкөӯмқҳ н•ң м—°кө¬м—җ л”°лҘҙл©ҙ л§Ңм„ұ мӨ‘мқҙм—јмқҳ мһ¬л°ңмқ„ мқјмңјнӮ¬ мҲҳ мһҲлҠ” мң„н—ҳ мҡ”мҶҢлЎңлҠ” мҲ м „ лӢӨм ң лӮҙм„ұ к· мЈј к°җм—ј кё°мҷ•л Ҙ, 60м„ё мқҙмғҒмқҳ лӮҳмқҙ, лӢ№лҮЁлі‘ л“ұмқҙ мһҲлӢӨ[5]. мҲ нӣ„ к°җм—јмқҖ л§Ңм„ұ мӨ‘мқҙм—јмқҳ мһ¬л°ңмқ„ мқјмңјнӮ¬ мҲҳ мһҲлҠ” мӨ‘мҡ”н•ң мҰқмғҒмқҙкё° л•Ңл¬ём—җ ліё м—°кө¬м—җм„ңлҠ” нҷҳмһҗмқҳ м—°л № 분нҸ¬ л°Ҹ кё°м Җм§Ҳнҷҳм—җ лҢҖн•ҙм„ңлҸ„ мЎ°мӮ¬н•ҳмҳҖлӢӨ. м—°кө¬м—җ мҲ нӣ„ к°җм—јмқҙ л°ңмғқн•ҳм§Җ м•ҠмқҖ нҷҳмһҗлҠ” нҸ¬н•Ёлҗҳм§Җ м•Ҡм•„ мң мқҳлҜён•ң нҶөкі„м Ғ 분м„қмқҖ м–ҙл Өмӣ мңјлӮҳ, лӢ№лҮЁлі‘мқ„ кё°м Җм§ҲнҷҳмңјлЎң к°Җм§Җкі мһҲлҠ” нҷҳмһҗлҠ” 3лӘ…мңјлЎң 비көҗм Ғ м ҒмқҖ кІғмқ„ нҷ•мқён• мҲҳ мһҲм—ҲлӢӨ. лҳҗн•ң 60м„ёлҘј кё°мӨҖмңјлЎң 60м„ё мқҙмғҒмқҖ 17лӘ…, 60м„ё лҜёл§ҢмқҖ 16лӘ…мңјлЎң 비көҗм Ғ кі лҘё лҢҖ비лҘј ліҙмҳҖлӢӨ.
2001л…„м—җм„ң 2010л…„к№Ңм§Җ м•Ҫ 10л…„к°„ к· мЈј ліҖнҷ”м—җ кҙҖн•ң көӯлӮҙ ліҙкі м—җ л”°лҘҙл©ҙ, л§Ңм„ұ мӨ‘мқҙм—ј нҷҳмһҗмқҳ к· мЈјлҠ” Methicillin-sensitive Staphylococcus aureus (MSSA) 28.5%, Pseudomonas aeruginosa 20.4%, MRSA 8.5%, CoNS 7.2% мҲңмқҙм—ҲлӢӨ[6]. н•ҳм§Җл§Ң ліё м—°кө¬м—җм„ң нҷ•мқён•ң л§Ңм„ұ мӨ‘мқҙм—ј мҲ нӣ„ к°җм—ј нҷҳмһҗм—җм„ң мӢңн–үн•ң к· мЈјмқҳ л°ңмғқ л№ҲлҸ„лҠ” MRSA, CRPA, кё°нғҖ к· мЈј мҲңмқҙм—Ҳмңјл©°, 57.6%к°Җ нқ”нһҲ мӮ¬мҡ©н•ҳлҠ” кІҪн—ҳм Ғ н•ӯмғқм ңм—җ лҢҖн•ң лӮҙм„ұк· мқҙм—ҲлӢӨ. мқҙлҠ” нқ”нһҲ мІҳл°©лҗҳлҠ” кІҪкө¬ кҙ‘лІ”мң„ н•ӯмғқм ңм—җ лӮҙм„ұмқ„ к°–лҠ” к· мқҙ л§Ңм„ұ мӨ‘мқҙм—јм—җм„ң м „мІҙ лҸҷм •лҗҳлҠ” к· мқҳ м•Ҫ 37%лҘј м°Ём§Җн•ңлӢӨлҠ” кё°мЎҙм—җ м•Ңл Ө진 м—°кө¬м—җ 비н•ҙ 비көҗм Ғ лҶ’мқҖ мҲҳм№ҳлҘј ліҙмҳҖлӢӨ[3]. лҳҗн•ң мҲ м „ лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬м—җм„ң лҸҷм •лҗң к· мЈјмҷҖ мҲ нӣ„ к°җм—ј нӣ„ лҸҷм •лҗң к· мЈјк°Җ мқјм№ҳн–ҲлҚҳ кІҪмҡ°лҠ” мҙқ 3кұҙм—җ л¶Ҳкіјн–ҲлҚҳ кІғмңјлЎң лҜёлЈЁм–ҙ ліҙм•„ кё°мЎҙ м—°кө¬м—җм„ң л°қнҳҖ진 л§Ңм„ұ мӨ‘мқҙм—ј нҷҳмһҗмқҳ мқҙлЈЁм—җм„ң л°°м–‘лҗҳлҠ” к· мЈјмқҳ мҲңмң„мҷҖ мҲ нӣ„ к°җм—ј л°ңмғқмқ„ мқјмңјнӮӨлҠ” к· мЈјлҠ” м°ЁмқҙлҘј ліҙмқҙкі мһҲмқҢмқ„ нҷ•мқён• мҲҳ мһҲлӢӨ(Table 3). мқҙлҹ¬н•ң м°Ёмқҙмқҳ мқҙмң лЎң мҲҳмҲ м „нӣ„ лҸҷм •лҗң к· мЈјк°Җ мқјм№ҳн•ҳлҠ” кІҪмҡ°к°Җ л§Өмҡ° м Ғмңјл©°, мҲ нӣ„ к°җм—јк· мқҳ лҢҖл¶Җ분мқҙ н•ӯмғқм ң лӮҙм„ұк· мһ„мқ„ кі л Өн•ҳмҳҖмқ„ л•Ң кё°мЎҙ лі‘мӣҗк· мқҙ мһ”мЎҙн•ҙ мһҲкё°ліҙлӢӨлҠ” мҲҳмҲ мӨ‘ к°җм—ј л°Ҹ мӣҗлӮҙ к°җм—јмқҳ к°ҖлҠҘм„ұмқҙ лҶ’мқ„ кІғмңјлЎң мғқк°ҒлҗңлӢӨ.
ліё м—°кө¬мқҳ лҢҖмғҒмқҙ лҗң нҷҳмһҗкө°мқҖ мҲҳмҲ мқҙнӣ„ н•©лі‘мҰқ л°Ҹ к°җм—јмқ„ мҳҲл°©н•ҳкё° мң„н•ң н•ӯмғқм ңлҘј мӮ¬мҡ©н–ҲмқҢм—җлҸ„ лӢӨмӢң к°җм—јмқҙ л°ңмғқн•ң кІҪмҡ°лЎң, мҲ нӣ„ мӢ¬н•ң м—јмҰқ мҶҢкІ¬мқҙ мһҲлӢӨл©ҙ н•ӯмғқм ң лӮҙм„ұ к· мЈјк°Җ лі‘мқёмқј к°ҖлҠҘм„ұмқҙ лҶ’мқ„ кІғмңјлЎң м¶”лЎ н• мҲҳ мһҲлӢӨ. мқҙм—җ м—°кө¬ лҢҖмғҒмһҗл“Өм—җкІҢлҠ” лҢҖмІҙлЎң н•ӯмғқм ң лӮҙм„ұ к· мЈјм—җ к°җмҲҳм„ұмқҙ мһҲлҠ” кІҪн—ҳм Ғ н•ӯмғқм ңл“Өмқҙ мЈјлЎң мӮ¬мҡ©лҗҳм—ҲлӢӨ. ліёмӣҗм—җм„ң мҙҲкё°м—җ кІҪн—ҳм ҒмңјлЎң м„ нғқн•ң н•ӯмғқм ңлҠ” ceftazidimeмқҙ 16кұҙ(48.48%)лЎң к°ҖмһҘ л§Һм•ҳкі , vancomycinмқҙ 9кұҙ(27.27%), flomoxefмҷҖ ceftriaxoneмқҙ к°Ғк°Ғ 2кұҙ(6.06%), gemifloxacin, ertapenem, sulfamethoxazole-trimethoprim, piperacillin-tazobactamмқҙ к°Ғк°Ғ 1кұҙ(3.03%)м”© мӮ¬мҡ©лҗҳм—ҲлӢӨ. ліё м—°кө¬м—җм„ң мҲ м „ л°°м–‘ кІҖмӮ¬к°Җ м—ҶлҠ” кІҪмҡ° мЎ°мӮ¬лҗң кё°к°„мқҳ мҙҲл°ҳ л°Ҹ мӨ‘л°ҳм—җлҠ” л§Ңм„ұ мӨ‘мқҙм—ј нҷҳмһҗм—җм„ң fluoroquinolone мқҙмҡ©м•Ўмқҳ кҙ‘лІ”мң„н•ң мӮ¬мҡ©мңјлЎң ciprofloxacinм—җ лҢҖн•ң лӮҙм„ұмқ„ м§ҖлӢҢ Pseudomonas мҰқк°Җк°Җ ліҙкі лҗҳм–ҙ кІҪн—ҳм Ғ н•ӯмғқм ңлЎң ceftazidimeмқ„ м„ нғқн•ҳмҳҖлӢӨ[7]. н•ҳм§Җл§Ң кІҪн—ҳм Ғ н•ӯмғқм ңлЎң ceftazidimeмқ„ мӮ¬мҡ© мӨ‘ мӢңн–үлҗң лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬ кІ°кіј MRSAк°Җ л§Һмқҙ лҸҷм •лҗҳм—Ҳкё° л•Ңл¬ём—җ, мЎ°мӮ¬лҗң кё°к°„мқҳ нӣ„л°ҳм—җлҠ” к· мЈј лҸҷм • м „ vancomycinмқ„ кІҪн—ҳм ҒмңјлЎң м„ нғқн•ҳмҳҖлӢӨ. ліё м—°кө¬ кІ°кіјм—җ л”°лҘҙл©ҙ мҲ нӣ„ к°җм—јк· м—җм„ң MRSAк°Җ 15кұҙ(45.45%)мңјлЎң CRPA (12.12%)м—җ 비н•ҙ нҷ•м—°нһҲ л§ҺмқҖ мҲҳк°Җ лҸҷм •лҗҳм—ҲлӢӨ. л”°лқјм„ң мҲ нӣ„ к°җм—ј л°ңмғқ мӢң ceftazidimeліҙлӢӨлҠ” 1м°Ём ҒмңјлЎң MRSAм—җ лҶ’мқҖ к°җмҲҳм„ұмқ„ к°Җ진 vancomycin, teicoplanin л“ұмқҳ мӮ¬мҡ©мқҙ лҚ” м Ғм Ҳн• кІғмңјлЎң мӮ¬лЈҢлҗңлӢӨ. лҳҗн•ң ліё м—°кө¬лҠ” мҲ нӣ„ к°җм—ј мӢң к°җм—јк· м—җ л”°лҘё м№ҳлЈҢ кё°к°„м—җ лҢҖн•ң м •ліҙлҘј нҸ¬н•Ён•ҳкі мһҲм–ҙ мһ„мғҒм ҒмңјлЎң нҒ° мқҳлҜёлҘј к°Җм§Ҳ мҲҳ мһҲмқ„ кІғмңјлЎң мғқк°ҒлҗңлӢӨ.
м ңн•ңм җліё м—°кө¬лҠ” л§Ңм„ұмӨ‘мқҙм—ј мҲҳмҲ нӣ„ мӢ¬н•ң мҲҳмҲ нӣ„ к°җм—јмңјлЎң мһ…мӣҗм№ҳлЈҢлҘј мӢңн–үн•ң нҷҳмһҗл§Ңмқ„ лҢҖмғҒмңјлЎң н•ҳмҳҖлӢӨ. л”°лқјм„ң мҲ нӣ„ 추м Ғ кҙҖм°° мӨ‘ кІҪлҸ„мқҳ мҲ нӣ„ к°җм—јмқ„ ліҙмқҙлҠ” нҷҳмһҗл“ӨмқҖ м ңмҷёлҗҳм—Ҳкё° л•Ңл¬ём—җ мҲ нӣ„ к°җм—јк· м—җм„ң н•ӯмғқм ң лӮҙм„ұк· мқҳ 비мңЁмқҙ лҶ’мқ„ мҲҳ л°–м—җ м—Ҷмқ„ кІғмңјлЎң мғқк°ҒлҗңлӢӨ. лҳҗн•ң ліё м—°кө¬лҠ” мҲ нӣ„ к°җм—јмңјлЎң мһ…мӣҗн•ң нҷҳмһҗ 33мқём—җ лҢҖн•ҙм„ңл§Ң 분м„қн•ҳмҳҖкё° л•Ңл¬ём—җ к·ё лҢҖмғҒмқҙ мһ‘м•„ мҲ нӣ„ к°җм—ј м „мІҙм—җ м Ғмҡ©н•ҳкё°м—җлҠ” м ңн•ңмқҙ мһҲлӢӨ. 추нӣ„ л§Ңм„ұмӨ‘мқҙм—ј мҲҳмҲ мқ„ мӢңн–үн•ң м „мІҙ нҷҳмһҗ мҲҳлҘј лҢҖмғҒмңјлЎң н•ҳм—¬ 진лӢЁлі„, м—°л №лі„, мҲҳмҲ л°©лІ•м—җ л”°лҘё мҲ нӣ„ к°җм—јм—җ лҢҖн•ң 추к°Җ м—°кө¬к°Җ н•„мҡ”н• кІғмңјлЎң мӮ¬лЈҢлҗңлӢӨ.
кІ°лЎ м ҒмңјлЎң, л§Ңм„ұ мӨ‘мқҙм—ј мҲ нӣ„ к°җм—ј л°ңмғқ нҷҳмһҗмқҳ мқҙлЈЁм—җм„ң л°°м–‘лҗҳлҠ” к· мЈјлҠ” м•Ҫм ң лӮҙм„ұ к· мЈјмқҳ 비мңЁмқҙ л§Өмҡ° лҶ’мңјл©°, мҲ м „м—җ мқҙлЈЁм—җм„ң л°°м–‘лҗҳлҠ” к· мЈјмҷҖ к°ҷм•ҳлҚҳ кІҪмҡ°лҠ” 3кұҙмңјлЎң кІ°кіјк°Җ лӢӨлҘё кІҪмҡ°к°Җ лҚ” л§ҺмқҢмқ„ лҜёлЈЁм–ҙ ліҙм•ҳмқ„ л•Ң, мҲ нӣ„ к°җм—ј л°ңмғқ мӢңм—җ лҜёмғқл¬ј л°°м–‘ кІҖмӮ¬лҠ” н•„мҲҳм ҒмқҙлқјлҠ” кІғмқ„ м•Ң мҲҳ мһҲлӢӨ. лҳҗн•ң мҲ нӣ„ к°җм—ј мӢң мӮ¬мҡ©н• кІҪн—ҳм Ғ н•ӯмғқм ңлЎңлҠ” MRSAм—җ лҶ’мқҖ к°җмҲҳм„ұмқ„ ліҙмқҙлҠ” vancomycin лҳҗлҠ” teicoplaninмқ„ м„ нғқн•ҳлҠ” кІғмқҙ м Ғм Ҳн•ҳкІ мңјлӮҳ, vancomycinмқҖ лӮҙм„ұ к· мЈјк°Җ л°ңмғқн• мң„н—ҳмқҙ мһҲм–ҙ мҙҲкё°л¶Җн„° кІҪн—ҳм Ғ н•ӯмғқм ңлЎң м„ нғқн•ҳкё°м—җлҠ” мһ„мғҒм ҒмңјлЎң м–ҙл ӨмӣҖмқҙ мһҲлӢӨ. л”°лқјм„ң лӢӨлҘё кІҪн—ҳм Ғ н•ӯмғқм ңлҘј мӮ¬мҡ©н•ҳкІҢ лҗҳлҚ”лқјлҸ„, ліё м—°кө¬мҷҖ к°ҷмқҙ MRSAк°Җ лҸҷм •лҗ к°ҖлҠҘм„ұмқҙ лҶ’мқҢмқ„ м—јл‘җм—җ л‘җкі кІ°кіјк°Җ лӮҳмҳӨлҠ” мҰүмӢң н•ҙлӢ№ к· мЈјм—җ к°җмҲҳм„ұмқ„ ліҙмқҙлҠ” н•ӯмғқм ңлЎң ліҖкІҪн•ҳлҠ” кІғмқҙ н•„мҡ”н• кІғмңјлЎң мӮ¬лЈҢлҗңлӢӨ.
NotesAuthor contributions Conceptualization: Hyong-Ho Cho. Data curation: Keon-Woo Park, Dong-Eun Lee. Formal analysis: Keon-Woo Park, Dong-Eun Lee. Investigation: Keon-Woo Park, Hong Chan Kim. Methodology: Hyong-Ho Cho. Supervision: Hyong-Ho Cho, Hong Chan Kim. Validation: Keon-Woo Park. Visualization: Keon-Woo Park. WritingвҖ”original draft: Keon-Woo Park. WritingвҖ”review & editing: Hong Chan Kim, Hyong-Ho Cho. Fig.В 2.Identified strains from preoperative and postoperative culture. The most identified strain was MRSA, and there were only three cases of the same strain identified before and after surgery. MRSA, Methicillin-resistant Staphylococcus aureus; MRSE, Methicillin-resistant Staphylococcus epidermis; MRSL, Methicillin-resistant Staphylococcus lugdunensis; CRPA, Ciprofloxacin-resistant Pseudomonas aeruginosa>; CSPA, Ciprofloxacin susceptible Pseudomonas aeruginosa; CoNS, Coagulase-negative Staphylococcus. 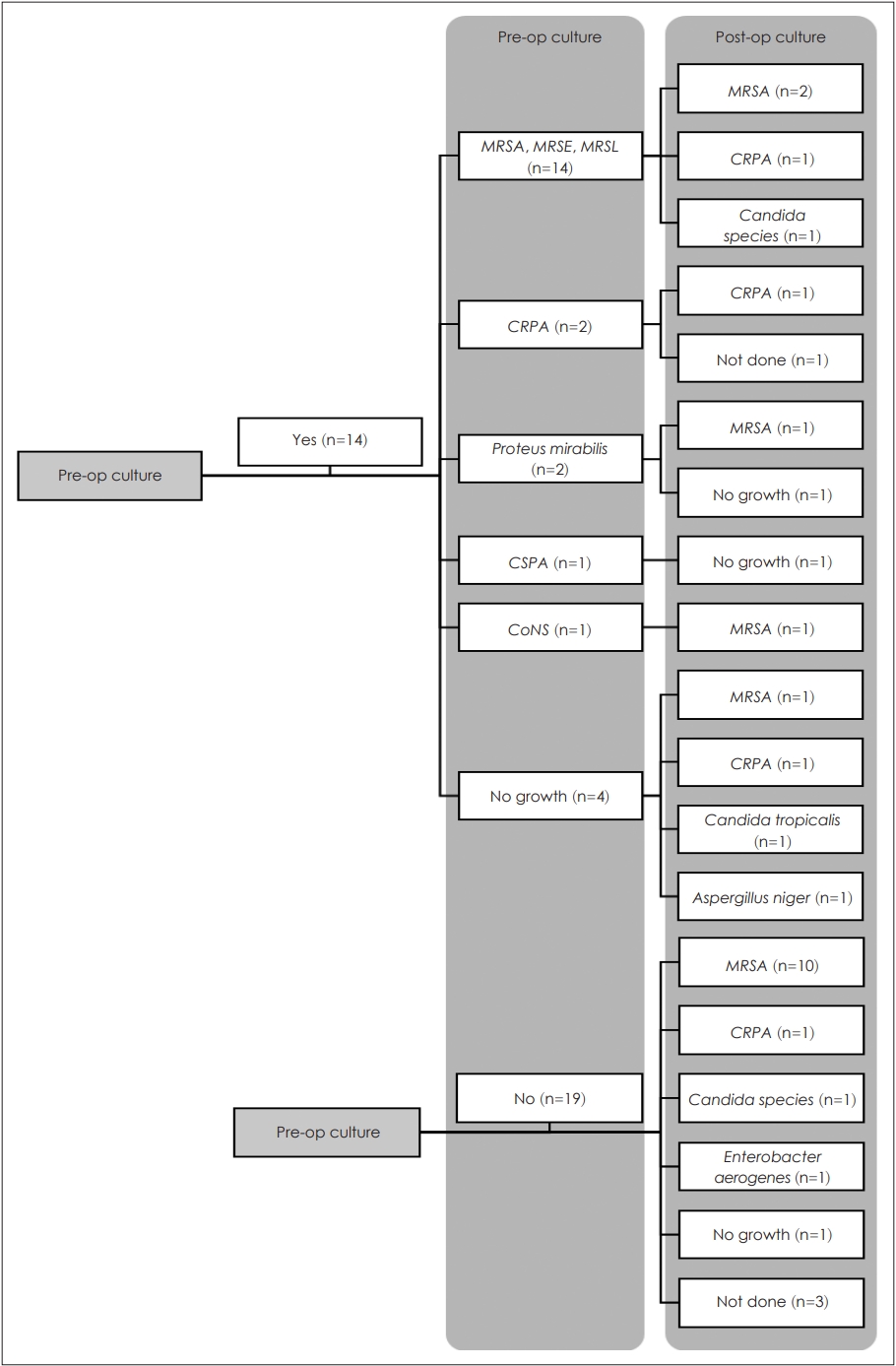
Fig.В 3.Changes in antibiotics after microbial culture. Antibiotics were changed for bacteria that did not respond to existing empirical antibiotics. MRSA, Methicillin-resistant Staphylococcus aureus; CRPA, Ciprofloxacin-resistant Pseudomonas aeruginosa. 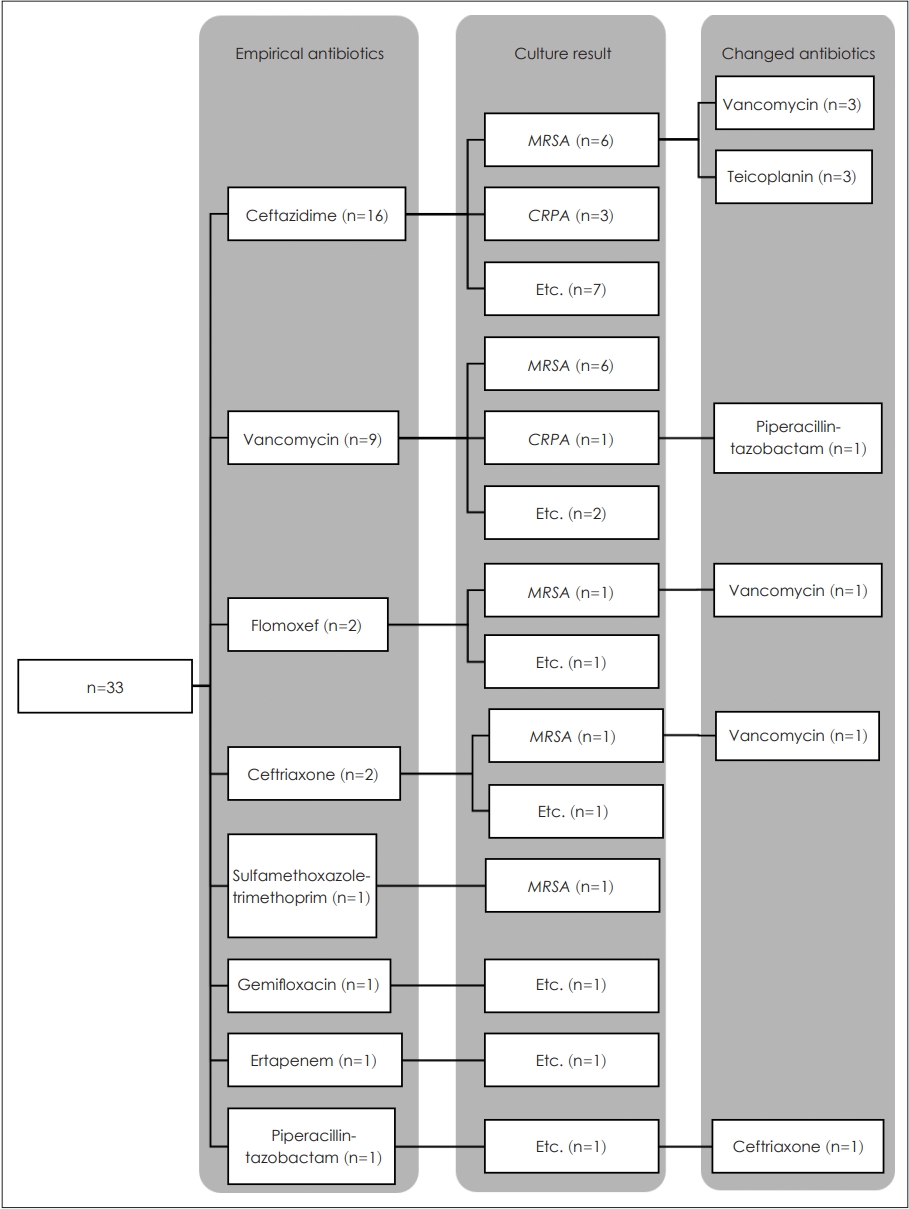
TableВ 1.Participants demographics (sex, age, preoperative diagnosis) (n=33) TableВ 2.Results of postoperative microbial culture (n=33) TableВ 3.Culture results after post-op infection followed by antibiotics change (n=33) TableВ 4.Total treatment period when MRSA or CRPA is detected in postoperative culture (n=17)
TableВ 5.Total treatment period when vancomycin or ceftazidime is used as secondary empirical antibiotics REFERENCES2. Bareeqa SB, Ahmed SI. Comment to empirical therapy for chronic suppurative otitis media. Clin Med Insights Ear Nose Throat 2018;11:1179550618810226.
3. Lee JS, Kim MG, Hong SM, Na SY, Byun JY, Park MS, et al. Changing patterns of bacterial strains in adults and children with otitis media in Korean ter tiar y care centers. Clin Exp Otorhinolaryngol 2014;7(2):79-86.
4. Sim JH, Kim KT, Lee SH, Yun SH. Bacteriologic study of chronic suppurative otitis media. Korean J Otorhinolaryngol-Head Neck Surg 1997;40(6):819-26.
5. Khanna V, Chander J, Nagarkar NM, Dass A. Clinicomicrobiologic evaluation of active tubotympanic type chronic suppurative otitis media. J Otolaryngol 2000;29(3):148-53.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 |
 |